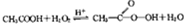题目内容
15.下列反应属于氧化还原反应的是( )| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断..
解答 解:A.CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2反应中,C、H元素的化合价发生变化,属于氧化还原反应,故A正确;
B.CaCO3+H2O+CO2═Ca(HCO3)2为化合反应,没有元素的化合价发生变化,不属于氧化还原反应,故B错误;
C.CuO+2HCl═CuCl2+H2O反应中,不存在化合价变化,不属于氧化还原反应,故C错误;
D.NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑为分解反应,不存在化合价变化,不属于氧化还原反应,故D错误;
故选A.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
5.室温下向10mLpH=3的醋酸溶液中加入水稀释后.下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中醋酸根浓度与醋酸分了浓度比值变大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液的导电能力增强 |
3.800℃时,反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数K=1,现向某一密闭容器中充入1.2molCO和0.6mol H2O(g)发生反应,一定时间后达到化学平衡状态,保持温度不变,下列说法正确的是( )
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
10.下列关于有机化合物的说法正确的是( )
| A. | 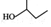 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H2Cl6 有4种同分异构体 | D. | C2H4和C4H8一定是同系物 |
20.W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
| A. | 离子半径:W>Z>X | B. | 单质熔点:W>Z | ||
| C. | 最高正价:W>X>Y>Z | D. | 原子序数:Z>W>X>Y |
7.下列实验所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
4.实验室模拟工业制备高纯铁.用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示. 下列说法不正确的是( )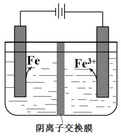

| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
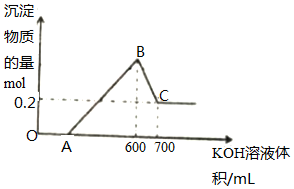 将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体.向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示: 过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下: