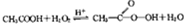题目内容
13.NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,11.2LCH3Cl含极性共价键数目为2NA | |
| B. | 0.1L 1.0mol/L Na2S溶液中S2-和HS-总数为0.1NA | |
| C. | 22.4g 铁粉与稀硝酸完全反应时转移的电子数一定为1.2NA | |
| D. | 常温常压下,16g14CH4中所含电子数目为8NA |
分析 A、求出一氯甲烷的物质的量,然后根据一氯甲烷中含4条极性共价键来分析;
B、S2-部分水解为HS-和H2S分子;
C、铁和稀硝酸反应后最终可能变为+3价,还可能变为+2价;
D、14CH4的摩尔质量为18g/mol.
解答 解:A、标况下11.2L一氯甲烷的物质的量为0.5mol,而一氯甲烷中含4条极性共价键,故0.5mol一氯甲烷中含02NA条极性共价键,故A正确;
B、S2-部分水解为HS-和H2S分子,故溶液中的S2-、HS-、H2S总数为0.1NA个,故B错误;
C、铁和稀硝酸反应后最终可能变为+3价,还可能变为+2价,故转移的电子数不一定是1.2NA个,故C错误;
D、14CH4的摩尔质量为18g/mol,故16g此甲烷的物质的量为n=$\frac{16g}{18g/mol}$=$\frac{8}{9}$mol,而1mol甲烷中含10mol电子,故$\frac{8}{9}mol$甲烷中含有的电子的个数为$\frac{80}{9}$NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
3.800℃时,反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数K=1,现向某一密闭容器中充入1.2molCO和0.6mol H2O(g)发生反应,一定时间后达到化学平衡状态,保持温度不变,下列说法正确的是( )
| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
4.实验室模拟工业制备高纯铁.用惰性电极电解FeSO4溶液制备高纯铁的原理如图所示. 下列说法不正确的是( )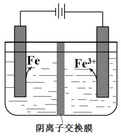

| A. | 阴极主要发生反应:Fe2++2e-═Fe | |
| B. | 向阳极附近滴加KSCN溶液,溶液变红 | |
| C. | 电解一段时间后,阴极附近pH减小 | |
| D. | 电解法制备高纯铁总反应:3Fe2+$\frac{\underline{\;电解\;}}{\;}$Fe+2Fe3+ |
1.一定量的某饱和一元醛发生银镜反应可得10.8g银,将等量的该醛完全燃烧,生成2.7g水.此醛可能是( )
| A. | 乙醛 | B. | 丙醛 | C. | 丁醛 | D. | 戊醛 |
8.下列关于有机物结构或性质说法正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 光照条件下1mol CH4与3mol Cl2反应可制得1mol CHCl3 | |
| C. | 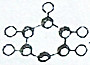 为苯分子的比例模型 为苯分子的比例模型 | |
| D. | HC≡C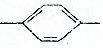 CH═CHCH3中所有碳原子有可能都在同一个平面内 CH═CHCH3中所有碳原子有可能都在同一个平面内 |
4.卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按图所示工艺流程进行生产,可制得轻质氧化镁.

若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:
1、25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14.
2、Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
3、原料价格表
(1)请设计实验证明卤块中既含有Fe3+又有Fe2+取样,加水溶解,将溶液分成两份,往其中一份滴加硫氰化钾溶液,若溶液变红,则说
明卤块中含铁离子,往另一份溶液中滴加酸性高锰酸钾溶液,若酸性高锰酸钾溶液褪色,则说明含亚铁离子.
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO),其作用是使溶液中Fe2+氧化成为Fe3+,便于除去.
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑥中发生的反应是Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+MgO.
(4)请写出氧化镁的一种用途:耐火材料、食品添加剂、抗酸剂、催化剂、制造镁盐的原料等,步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,当pH=3,c(Fe3+)沉淀完全.测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=1×10-8mol/L.

若要求产品尽量不含杂质,而且生产成本较低,根据以下资料,填写空白:
已知:
1、25℃,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Fe(OH)2]=8.0×10-16,
Ksp[Mg(OH)2]=1.8×10-11,Ksp[Mn(OH)2]=4.0×10-14.
2、Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去.
3、原料价格表
| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
明卤块中含铁离子,往另一份溶液中滴加酸性高锰酸钾溶液,若酸性高锰酸钾溶液褪色,则说明含亚铁离子.
(2)在步骤②中加入的试剂X,最佳的选择是漂液(NaClO),其作用是使溶液中Fe2+氧化成为Fe3+,便于除去.
(3)在步骤③中加入的试剂Y应是烧碱(NaOH),步骤⑥中发生的反应是Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+MgO.
(4)请写出氧化镁的一种用途:耐火材料、食品添加剂、抗酸剂、催化剂、制造镁盐的原料等,步骤⑥如在实验室进行,应选用在坩埚(填仪器名称)中灼烧.
(5)25℃,往卤块对应的水溶液中,加入一定量的烧碱达到沉淀溶液平衡,当pH=3,c(Fe3+)沉淀完全.测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=1×10-8mol/L.
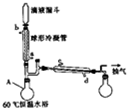 过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下:
过氧乙酸常用作氧化剂和灭菌剂,实验室合成过氧乙酸并测定其含量的相关步骤如下: