题目内容
前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物.M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄.
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 .
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、π键之比是 .
(3)上述五种元素能形成的晶体类型有 (填编号).
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298K时固体M在氧气中燃烧生成1mol M203固体时,放出热量1676.2kJ;固体N在氧气中燃烧生成1mol N304固体时,放出热量1118.4kJ.请写出298K时,由M单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是 .
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、π键之比是
(3)上述五种元素能形成的晶体类型有
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298K时固体M在氧气中燃烧生成1mol M203固体时,放出热量1676.2kJ;固体N在氧气中燃烧生成1mol N304固体时,放出热量1118.4kJ.请写出298K时,由M单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X单质是密度最小的物质,则X为H元素;Y原子最外层电子数是次外层的两倍,Y含有两个电子层,最外层含有4个电子,则Y为C元素;Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物,则Z为N元素;N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄,则N为Fe元素;M元素的p电子总数比s电子总数多1,1s22s22p5或1s22s22p63s23p1,且六种元素中有两种是金属元素,则M为Al元素,据此进行解答.
解答:
解:X单质是密度最小的物质,则X为H元素;Y原子最外层电子数是次外层的两倍,Y含有两个电子层,最外层含有4个电子,则Y为C元素;Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物,则Z为N元素;N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄,则N为Fe元素;M元素的p电子总数比s电子总数多1,1s22s22p5或1s22s22p63s23p1,且六种元素中有两种是金属元素,则M为Al元素,
(1)M为Al元素,Al的原子序数为13,其基态电子排布式为:1s22s22p63s23p1或[Ne]3s23p1,
故答案为:1s22s22p63s23p1或[Ne]3s23p1;
(2)Y为C、Z为N,直线型分子C2N2中所有原子都达到8电子稳定结构,则C2N2的结构简式为:N≡C-C≡N,三键中含有2个π键、1个δ键,则其分子中含有的δ键、π键之比为:(1×2+1):(2×2)=3:4,
故答案为:3:4;
(3)X是氢元素,Y是碳元素,Z是氮元素,M是铝元素,N是铁元素,①原子晶体:金刚石、②分子晶体:氢气,氮气、③离子晶体:硝酸铝、④金属晶体:铁,所以①②③④都正确,
故答案为:①②③④;
(4)M为Al元素,298K时固体Al在氧气中燃烧生成1mol氧化铝固体放出热量1676.2kJ,反应的热化学方程式为:①4Al+3O2=2Al2O3 △H=-3352.4kJ/mol,
N为Fe元素,固体铁在氧气中燃烧生成1mol Fe304固体时,放出热量1118.4kJ,反应的热化学方程式为:②3Fe+2O2═Fe3O4 △H=-1118.4kJ/mol,
根据盖斯定律,①×2-②×3可得Al单质与Fe304反应的热化学方程式:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s);△H=-3349.6KJ/mol,
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s);△H=-3349.6KJ/mol;
(5)在沸水中加入Fe的某高价盐饱和溶液可以得到一种红褐色的液体,得到为混合物为氢氧化铁胶体,N的最高价氧化物的水化物硝酸,向氢氧化铁胶体中进入硝酸溶液直至过量的过程中,氢氧化铁胶体先出现聚沉现象,之后氢氧化铁与硝酸反应,沉淀会逐渐溶解,所以出现的现象为:先出现沉淀,然后沉淀溶解,
故答案为:先出现沉淀,然后沉淀溶解.
(1)M为Al元素,Al的原子序数为13,其基态电子排布式为:1s22s22p63s23p1或[Ne]3s23p1,
故答案为:1s22s22p63s23p1或[Ne]3s23p1;
(2)Y为C、Z为N,直线型分子C2N2中所有原子都达到8电子稳定结构,则C2N2的结构简式为:N≡C-C≡N,三键中含有2个π键、1个δ键,则其分子中含有的δ键、π键之比为:(1×2+1):(2×2)=3:4,
故答案为:3:4;
(3)X是氢元素,Y是碳元素,Z是氮元素,M是铝元素,N是铁元素,①原子晶体:金刚石、②分子晶体:氢气,氮气、③离子晶体:硝酸铝、④金属晶体:铁,所以①②③④都正确,
故答案为:①②③④;
(4)M为Al元素,298K时固体Al在氧气中燃烧生成1mol氧化铝固体放出热量1676.2kJ,反应的热化学方程式为:①4Al+3O2=2Al2O3 △H=-3352.4kJ/mol,
N为Fe元素,固体铁在氧气中燃烧生成1mol Fe304固体时,放出热量1118.4kJ,反应的热化学方程式为:②3Fe+2O2═Fe3O4 △H=-1118.4kJ/mol,
根据盖斯定律,①×2-②×3可得Al单质与Fe304反应的热化学方程式:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s);△H=-3349.6KJ/mol,
故答案为:8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s);△H=-3349.6KJ/mol;
(5)在沸水中加入Fe的某高价盐饱和溶液可以得到一种红褐色的液体,得到为混合物为氢氧化铁胶体,N的最高价氧化物的水化物硝酸,向氢氧化铁胶体中进入硝酸溶液直至过量的过程中,氢氧化铁胶体先出现聚沉现象,之后氢氧化铁与硝酸反应,沉淀会逐渐溶解,所以出现的现象为:先出现沉淀,然后沉淀溶解,
故答案为:先出现沉淀,然后沉淀溶解.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,试题涉及核外电子的排布、核外电子数、金属铝和铁的单质及其重要化合物性质、盖斯定律的应用、热化学方程式书写等知识,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力.

练习册系列答案
相关题目
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
有一包铁粉和铜粉混合物均匀的粉末样品,为了确定其组成,某同学将不同质量的该样品分别与40mL1mol?L-1的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
下列各组离子一定能大量共存的是( )
| A、醋酸溶液中:K+、Cu2+、Na+、C1-、SO42- | ||
| B、pH=ll的溶液中:HCO3-、Na+、NH3.H2O、NO3- | ||
C、常温下,
| ||
| D、在含有大量Fe3+的溶液中:A13+、Na+、S2-、Br- |
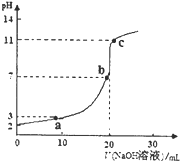 室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )
室温时,将0.10mol?L-1 NaOH溶液滴入20.00mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积变化曲线如图.下列有关说法不正确的是( )| A、该一元酸溶液浓度为0.10mol?L-1 |
| B、a、b、c点的水溶液导电性依次增强 |
| C、室温时,HA的电离常数Ka≈1×10-5 |
| D、a点和c点所示溶液中H2O的电离程度相同 |
通过实验可验证蔗糖水解可以生成葡萄糖,实验包括下列操作:其操作的正确顺序是( )
①加入少量蔗糖和水制成溶液 ②水浴加热 ③加入NaOH溶液中和酸并至溶液呈碱性 ④加入新制备的Cu(OH)2 ⑤加入少量稀硫酸 ⑥再加热.
①加入少量蔗糖和水制成溶液 ②水浴加热 ③加入NaOH溶液中和酸并至溶液呈碱性 ④加入新制备的Cu(OH)2 ⑤加入少量稀硫酸 ⑥再加热.
| A、①②⑤⑥④③ |
| B、①⑤②④⑥③ |
| C、①⑤②③④⑥ |
| D、①⑥④⑤③② |
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.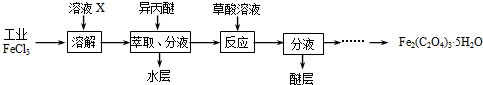
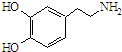 所示.试回答下列问题:
所示.试回答下列问题:
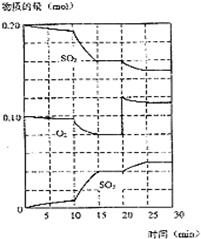 已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应:
已知600℃时,在2L密闭容器中,将二氧化硫和氧气混合发生反应: