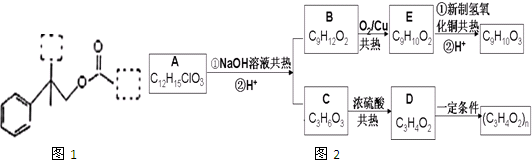
题目内容
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3?5H2O]的实验流程如图所示:
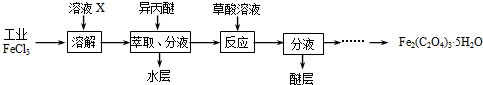
①为抑制FeCl3水解,溶液X为
②上述流程中FeCl3能被异丙醚萃取,其原因是
③所得Fe2(C2O4)3?5H2O需用冰水洗涤,其目的是
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于右图所示仪器
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3?5H2O.请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;
考点:制备实验方案的设计,铁的氧化物和氢氧化物,探究物质的组成或测量物质的含量
专题:实验题
分析:(1)①酸化FeCl3用盐酸酸化,不引入杂质;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;根据高锰酸钾的量计算草酸的含量,
a.没有润洗导致高锰酸钾浓度低消耗体积多;
b.读数高锰酸钾体积多;
c.读数体积偏小,结果偏低;
(2)该过程中生成亚铁离子需加双氧水氧化为铁离子,但实验的目的是得到铜单质,反应生成的是铜和剩余铁的混合物,故需加盐酸除去铜中的铁,并把反应滤液与前次合并,故操作为向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;直接加热FeCl3?6H2O会水解,为抑制水解需在HCl氛围下进行.
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;根据高锰酸钾的量计算草酸的含量,
a.没有润洗导致高锰酸钾浓度低消耗体积多;
b.读数高锰酸钾体积多;
c.读数体积偏小,结果偏低;
(2)该过程中生成亚铁离子需加双氧水氧化为铁离子,但实验的目的是得到铜单质,反应生成的是铜和剩余铁的混合物,故需加盐酸除去铜中的铁,并把反应滤液与前次合并,故操作为向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;直接加热FeCl3?6H2O会水解,为抑制水解需在HCl氛围下进行.
解答:
解:(1)①酸化FeCl3用盐酸酸化,不引入杂质,且抑制铁离子的水解,故答案为:(浓)盐酸;
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失,故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;
a.没有润洗导致高锰酸钾浓度低消耗体积多,偏高;
b.读数高锰酸钾体积多,偏高;
c.读数体积偏小,结果偏低,正确;
故答案为:甲;c;
(2)该过程中生成亚铁离子需加双氧水氧化为铁离子,但实验的目的是得到铜单质,反应生成的是铜和剩余铁的混合物,故需加盐酸除去铜中的铁,并把反应滤液与前次合并,故操作为向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;直接加热FeCl3?6H2O会水解,为抑制水解需在HCl氛围下进行,
故答案为:向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;将FeCl3?6H2O在HCl的气氛中加热脱水.
②萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;检验Fe3+用KSCN溶液效果最好;故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;取少量溶液,向其中滴加少量KSCN溶液,若溶液变红,则含有Fe3+;
③洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失,故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
④KMnO4标准溶液具有强氧化性,应置于酸式滴定管中;
a.没有润洗导致高锰酸钾浓度低消耗体积多,偏高;
b.读数高锰酸钾体积多,偏高;
c.读数体积偏小,结果偏低,正确;
故答案为:甲;c;
(2)该过程中生成亚铁离子需加双氧水氧化为铁离子,但实验的目的是得到铜单质,反应生成的是铜和剩余铁的混合物,故需加盐酸除去铜中的铁,并把反应滤液与前次合并,故操作为向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;直接加热FeCl3?6H2O会水解,为抑制水解需在HCl氛围下进行,
故答案为:向滤渣中加入足量HCl,充分反应后过滤、洗涤、干燥得铜粉;将两次过滤所得滤液合并,向其中加入适量H2O2溶液至Fe2+全部生成Fe3+;将FeCl3?6H2O在HCl的气氛中加热脱水.
点评:本题考查草酸铁晶体[Fe2(C2O4)3?5H2O]的制备,涉及试验流程问题,根据物质的性质进行分析处理,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某粒子的结构示意图为  该粒子的说法不正确的是( )
该粒子的说法不正确的是( )
 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )| A、核电荷数为9 |
| B、核外有两个电子层 |
| C、属于阴离子 |
| D、在化学反应中容易得到1个电子 |
为测定石灰石样品中碳酸钙(含SiO2杂质)的含量.现利用如图所示装置进行实验,充分反应后,测定装置C中生成的BaCO3沉淀质量.下列说法正确的是( )


| A、装置A中药品应为浓硫酸 |
| B、在B-C之间应增添盛有饱和NaHCO3溶液的洗气装置,以除去氯化氢气体 |
| C、为了测得C中生成的沉淀质量,需经过过滤、洗涤、干燥、称量等操作 |
| D、只要测定装置C在吸收CO2前后的质量差,也可以确定碳酸钙的质量分数 |
下列有关实验操作或实验原理正确的是( )

| A、提取溴水中的溴,可用加入乙醇萃取的方法 |
| B、用蒸发溶剂的方法将10%的氯化铁溶液变为20%的氯化铁溶液 |
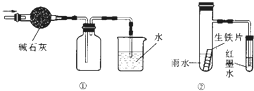
| C、用图 ①的装置可以收集一瓶干燥的氨气 |
| D、用图 ②的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |
某烃的结构简式为 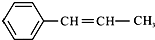 ,它可能具有的性质是( )
,它可能具有的性质是( )
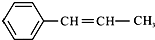 ,它可能具有的性质是( )
,它可能具有的性质是( )| A、能与H2发生加成反应,且需要1 mol H2 |
| B、分子里所有的原子都处在同一平面上 |
C、能发生加聚反应,其加聚产物可用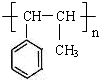 表示 表示 |
| D、该烃和苯互为同系物 |
下列叙述错误的是( )
| A、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| B、人造纤维、含成纤维和光导纤维都是有机高分子化合物 |
| C、在汽车排气管上加装“催化转化器”怒为了减少有害气体的排放 |
| D、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |