题目内容
15.金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”.工业上以金红石为原料制取Ti的反应为:aTiO2+bCl2+cC $\frac{\underline{\;1173K\;}}{\;}$ aTiCl4+cCO …反应I
TiCl4+2Mg $\frac{\underline{\;1220-1420K\;}}{\;}$Ti+2MgCl2…反应II
关于反应I、II的分析不正确的是( )
①TiCl4在反应I中是还原产物,在反应II中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应I、II中Mg的还原性大于Ti,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成0.1molTi,反应I、II中共转移0.4mol e-.
| A. | ①②④ | B. | ②③④ | C. | ② | D. | ②⑤ |
分析 在化学反应中得电子化合价降低的物质是氧化剂,在反应中被还原;失电子化合价升高的物质是还原剂,在反应中被氧化;氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;同一化学反应中还原剂的还原性大于还原产物的还原性;同一化学反应中反应前后遵循原子守恒定律.
解答 解:①aTiO2+bCl2+cC $\frac{\underline{\;1173K\;}}{\;}$ aTiCl4+cCO该反应中反应前后,碳元素的化合价升高,碳单质作还原剂,氯元素的化合价降低,氯气作氧化剂,还原产物是TiCl4;TiCl4+2Mg $\frac{\underline{\;1220-1420K\;}}{\;}$Ti+2MgCl2该反应中钛元素的化合价降低,TiCl4作氧化剂;
所以TiCl4在反应I中是还原产物,在反应II中是氧化剂,故正确;
②C、Mg在反应中反应前后化合价都升高,所以均为还原剂,被氧化,故错误;
③反应II中Mg能还原TiCl4,所以镁的还原性大于Ti;在反应I中碳作还原剂,TiCl4作还原产物,还原剂的还原性大于还原产物的还原性,所以C的还原性大于TiCl4,故正确.
④根据反应前后各元素的原子个数守恒知,$\left\{\begin{array}{l}{2a=c\\;}\\{2b=4a}\end{array}\right.$所以a=1,b=c=2;故正确;
⑤将方程式Ⅰ、Ⅱ相加得 TiO2+2Cl2+2C+2Mg=Ti+2CO+2MgCl2 转移电子
1mol 8mol
0.1mol 0.8mol
所以每生成0.1molTi,反应I、II中共转移0.8mole-,故错误.
故选D.
点评 本题考查了概念的判断、方程式的有关计算等知识点,难度不大,注意基本概念的理解、氧化还原反应中得失电子相等等问题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 在100mL的量筒里稀释浓硫酸溶液50mL | |
| D. | 用浓硫酸配制一定浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  | 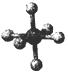 |  |  |
| 备注 | 熔点187K | 易溶于CS2 |
| A. | 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | NaCl晶体中每个Na+周围距离最近的Na+有6个 |
| A. | Na+ H+ NO3- Fe2+ | B. | Ca2+ H+ ClO- NO3- | ||
| C. | K+ H+ Cl- SO42- | D. | Fe3+ Cl- H+ CO32- |
 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g) (Ⅰ)
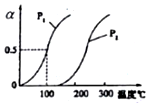
CH4的平衡转化率与温度、压强的关系如右图.
①己知100℃时达到平衡所需的时间为5min,则用H2表示的平均速率为0.0030mol•L-1•min-1.
②图中的P1<P2(填“<”“>”或“=”),100℃时平衡常数的值为2.25×10-4.
③在其它条件不变的情况下降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)(Ⅱ)
④该反应的△H<0,△S<0.(填“<”“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1molCO和3molH2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
| A. | 二者的分子个数之比为16:17 | |
| B. | 二者的原子个数之比为17:16 | |
| C. | 二者的氢原子个数之比为17:12 | |
| D. | 同温同压下两种气体的体积之比为16:17 |
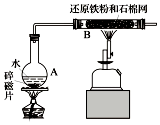 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去) ;A与C组成的化合物为MgS(用具体元素符号表示).
;A与C组成的化合物为MgS(用具体元素符号表示).