题目内容
4.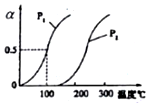 甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.(1)将1.0molCH4和2.0molH2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g) (Ⅰ)
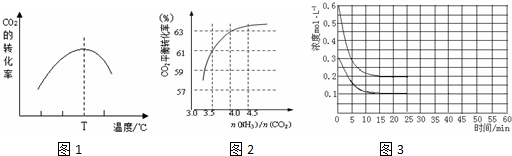
CH4的平衡转化率与温度、压强的关系如右图.
①己知100℃时达到平衡所需的时间为5min,则用H2表示的平均速率为0.0030mol•L-1•min-1.
②图中的P1<P2(填“<”“>”或“=”),100℃时平衡常数的值为2.25×10-4.
③在其它条件不变的情况下降低温度,逆反应速率将减小(填“增大”“减小”或“不变”).
(2)在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)(Ⅱ)
④该反应的△H<0,△S<0.(填“<”“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1molCO和3molH2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | $\frac{n(CO)}{n({H}_{2})}$ | P(MPa) |
| ⅰ | 150 | $\frac{1}{3}$ | 0.1 |
| ⅱ | 150 | $\frac{1}{3}$ | 5 |
| ⅲ | 350 | $\frac{1}{3}$ | 5 |
分析 (1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=$\frac{△c}{△t}$计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
平衡常数K=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$,计算出平衡时,各组分的浓度,代入平衡常数计算;
③降低温度,正逆反应速率都减小;
(2)④混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,正反应是气体物质的量减小的反应;
⑤容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析;
⑥寻找合成甲醇的温度和压强的适宜条件,先控制温度相同,比较压强;再控制压强相同,比较温度,其它因素不变,以此来解答.
解答 解:(1)①v(H2)=3v(CH4)=3×$\frac{\frac{1.0mol×0.5}{100L}}{5min}$=0.0030mol•L-1•min-1,
故答案为:0.0030mol•L-1•min-1;
②根据化学方程式可以得出,增大压强,化学平衡逆向移动,甲烷的转化率减小,可以去200℃来分析,发现甲烷的转化率是p1时大于p2时的,所以P1<P2,
CH4(g)+H2O(g)=CO(g)+3H2(g)
初始浓度:0.01 0.02 0 0
变化浓度:0.005 0.005 0.005 0.015
平衡浓度:0.005 0.015 0.005 0.015
100℃时平衡常数K=$\frac{0.005×(0.015)^{3}}{0.005×0.015}$(mol/L)2=2.25×10-4 (mol/L)2,
故答案为:<;2.25×10-4;
③降低温度,正逆反应速率都减小,故答案为:减小;
(2)④混合气体在催化剂作用下能自发反应生成甲醇,则说明正反应是放热反应,所以△H<0;正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0,
故答案为:<;<;
⑤A.该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B.将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C.充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D.再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故答案为:BD;
⑥由控制变量法可知,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,$\frac{n(CO)}{n({H}_{2})}$保持不变,均为$\frac{1}{3}$,比较使用ⅰ、ⅱ,压强不同,所以温度应相同,应为150℃,
故答案为:150;$\frac{1}{3}$;$\frac{1}{3}$.
点评 本题考查化学平衡的计算,为高频考点,把握图象分析、速率及K的计算、平衡移动、控制变量法为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.

| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
 是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
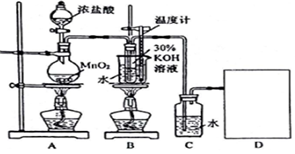
请按要求回答下列问题:
(1)请在D处方框内画出所需装置,并标注试剂名称.
装置A中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;当产生2.24mL(标准状况)Cl2时,转移电子数目为1.204×1022.
(2)B中反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该小组学生深入研讨后将B和C装置对调了位置,这样做的优点是提高氯酸钾的纯度.
(3)制取实验结束后,取出上图B中试管,经冷却结晶、过滤、洗涤、干燥,得晶体样品.
另取图C中氯水样品,进行如下实验,请分析:
①在少量样品中滴入几滴石蕊溶液后的现象是溶液先变红后褪色.
②测定其中所含氯元素的总量;在一定量试样中加入足量的H2O2溶液,充分反应后加热除去过量的H2O2,冷却,在加入足量的硝酸银溶液,经系列操作后,称取沉淀质量.其中加入的H2O2溶液的作用是将氯气、次氯酸、次氯酸根离子还原为氯离子.
(4)欲证明相同条件下HClO的电离常数大于HCO3-,实验方案是分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH.
(5)在不同条件下KClO3可将KI氧化成I2或KIO3.该小组设计了系列实验研究反应条件对产物的影响,其中某系列实验数据记录如表(均室温下进行);
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
②为使实验现象更加明显,此系列实验中还需添加的一种试剂是淀粉溶液.
反应Ⅰ.2NH4Cl+MgO$\frac{\underline{\;500~550℃\;}}{\;}$2NH3↑+MgCl2+H2O↑
反应Ⅱ.2MgCl2+O2$\frac{\underline{\;800~1000℃\;}}{\;}$2MgO+2Cl2
下列说法正确的是( )
| A. | 该工艺中MgO可循环利用 | |
| B. | 理论上 1mol NH4Cl制得Cl2的体积一定为11.2L | |
| C. | 在800~1000℃条件下,O2的还原性强于Cl2的还原性 | |
| D. | 若反应2NH3+MgCl2+H2O═2NH4Cl+MgO能自发进行,则该反应△H>0 |
 .
.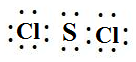 ,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.
,该反应的化学方程式为3SCl2+4H2O=2S+H2SO4+6HCl.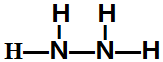 .常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.
.常温下,液体乙与气体丙反应生成两种无污染的物质,若共生成1mol产物时放热QKJ,该反应的热化学方程式为2N2H4(l)+2NO2(g)=3 N2(g)+4H2O(l)△H=-7QkJ/mol.