题目内容
6.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是置换出的铜与锌在硫酸中构成原电池,加快反应速率.
(3)实验室中现有Na2SO4、MgSO4、HgSO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是HgSO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升温、适当增大酸的浓度 (答两种).
分析 Fe与硫酸反应生成氢气,加少量硫酸铜,Fe可置换出Cu,构成原电池加快反应速率,或利用HgSO4代替硫酸铜,均为Fe作负极,且温度、浓度等均可加快反应速率,以此来解答.
解答 解:(1)实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu;Zn+H2SO4=ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是置换出的铜与锌在硫酸中构成原电池,加快反应速率,
故答案为:置换出的铜与锌在硫酸中构成原电池,加快反应速率;
(3)Na、K、Mg均比Fe活泼,不能发生置换反应,与上述实验中CuSO4溶液起相似作用的只有HgSO4,
故答案为:HgSO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升温、适当增大酸的浓度等,
故答案为:升高;适当增大酸的浓度.
点评 本题考查探究影响反应速率的因素,为高频考点,把握原电池、温度、浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意金属的活泼性,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
16.在含Ba2+、Ca2+、Ag+的酸性溶液中,可能存在的阴离子是( )
| A. | NO3- | B. | Cl- | C. | CO32- | D. | SO32- |
17.下列有机物命名正确的是( )
| A. | 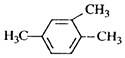 1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 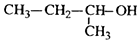 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 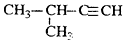 2-甲基-3-丁炔 2-甲基-3-丁炔 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
11.80℃时,2L密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+53kJ•mol-1,获得如下数据:下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 20~40s内,v(N2O4)=0.004mol/(L•s) | |
| B. | 在相同条件下,开始时若向容器中充入的是0.80 molNO2,达到平衡后NO2的转化率为75% | |
| C. | 反应达平衡时,吸收的热量为15.9 kJ | |
| D. | 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
16.某化学兴趣小组学生设计了制取KClO3和氯水的实验(装置如图所示),并进行相关性质的探究.
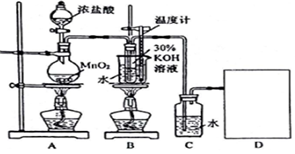
请按要求回答下列问题:
(1)请在D处方框内画出所需装置,并标注试剂名称.
装置A中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;当产生2.24mL(标准状况)Cl2时,转移电子数目为1.204×1022.
(2)B中反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该小组学生深入研讨后将B和C装置对调了位置,这样做的优点是提高氯酸钾的纯度.
(3)制取实验结束后,取出上图B中试管,经冷却结晶、过滤、洗涤、干燥,得晶体样品.
另取图C中氯水样品,进行如下实验,请分析:
①在少量样品中滴入几滴石蕊溶液后的现象是溶液先变红后褪色.
②测定其中所含氯元素的总量;在一定量试样中加入足量的H2O2溶液,充分反应后加热除去过量的H2O2,冷却,在加入足量的硝酸银溶液,经系列操作后,称取沉淀质量.其中加入的H2O2溶液的作用是将氯气、次氯酸、次氯酸根离子还原为氯离子.
(4)欲证明相同条件下HClO的电离常数大于HCO3-,实验方案是分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH.
(5)在不同条件下KClO3可将KI氧化成I2或KIO3.该小组设计了系列实验研究反应条件对产物的影响,其中某系列实验数据记录如表(均室温下进行);
①此系列实验中a=9.0.此系列实验目的是探究其他条件不变时,硫酸浓度对该反应产物的影响.
②为使实验现象更加明显,此系列实验中还需添加的一种试剂是淀粉溶液.

请按要求回答下列问题:
(1)请在D处方框内画出所需装置,并标注试剂名称.
装置A中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;当产生2.24mL(标准状况)Cl2时,转移电子数目为1.204×1022.
(2)B中反应的离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$5Cl-+ClO3-+3H2O.该小组学生深入研讨后将B和C装置对调了位置,这样做的优点是提高氯酸钾的纯度.
(3)制取实验结束后,取出上图B中试管,经冷却结晶、过滤、洗涤、干燥,得晶体样品.
另取图C中氯水样品,进行如下实验,请分析:
①在少量样品中滴入几滴石蕊溶液后的现象是溶液先变红后褪色.
②测定其中所含氯元素的总量;在一定量试样中加入足量的H2O2溶液,充分反应后加热除去过量的H2O2,冷却,在加入足量的硝酸银溶液,经系列操作后,称取沉淀质量.其中加入的H2O2溶液的作用是将氯气、次氯酸、次氯酸根离子还原为氯离子.
(4)欲证明相同条件下HClO的电离常数大于HCO3-,实验方案是分别测同温度物质的量浓度的次氯酸钠和碳酸氢钠溶液的pH.
(5)在不同条件下KClO3可将KI氧化成I2或KIO3.该小组设计了系列实验研究反应条件对产物的影响,其中某系列实验数据记录如表(均室温下进行);
| 实验 编号 | 试剂及其用量 | |||
| 0.2mol•L-1kJ/mL | KClO3(s)/g | 6.0mol•L-1H2SO4/mL | H2O/mL | |
| 1 | 1.0 | 0.1 | 0 | a |
| 2 | 1.0 | 0.1 | 3.0 | b |
| 3 | 1.0 | 0.1 | 6.0 | c |
| 4 | 1.0 | 0.1 | 9.0 | 0 |
②为使实验现象更加明显,此系列实验中还需添加的一种试剂是淀粉溶液.
 如图为A、B、C三种物质的溶解度曲线,据图回答下列问题:
如图为A、B、C三种物质的溶解度曲线,据图回答下列问题: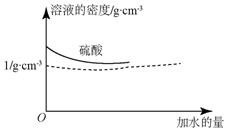 已知硫酸的密度与所加水量的关系如图所示,
已知硫酸的密度与所加水量的关系如图所示,