题目内容
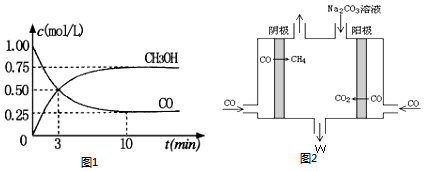
5.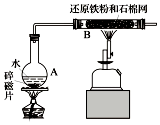 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验.(图中夹持及尾气处理装置均已略去)(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是防止暴沸.装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤.简述检验滤液中Fe3+的操作方法取少量滤液,滴入几滴KSCN溶液,观察到溶液变红色,则溶液中有Fe3+,否则,无Fe3+.
(3)若(2)实验中未检验到Fe3+的存在,则可能的原因是2Fe3++Fe═3Fe2+(用离子方程式表示).
分析 (1)烧瓶底部放置了几片碎瓷片是防止加热液体暴沸;铁和水蒸气反应生成四氧化三铁和氢气;
(2)根据检验铁离子的常用方法进行解答;
(3)根据铁离子能与铁反应.
解答 解:(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是防止暴沸,B中发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:防止暴沸;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)检验滤液中Fe3+的操作方法为取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
故答案为:取少量滤液,滴入几滴KSCN溶液,观察到溶液变红色,则溶液中有Fe3+,否则,无Fe3+;
(3)若(3)实验中未检验到Fe3+的存在,则可能的原因是:2Fe3++Fe═3Fe2+;
故答案为:2Fe3++Fe═3Fe2+.
点评 本题考查物质的性质及实验设计,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
17.根据下列实验现象所得出的结论错误的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO2溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO2 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO${\;}_{3}^{-}$被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
16.在含Ba2+、Ca2+、Ag+的酸性溶液中,可能存在的阴离子是( )
| A. | NO3- | B. | Cl- | C. | CO32- | D. | SO32- |
17.下列有机物命名正确的是( )
| A. | 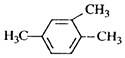 1,3,4-三甲苯 1,3,4-三甲苯 | B. | CH3CH(Cl)CH3 2-氯丙烷 | ||
| C. | 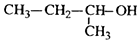 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 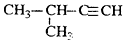 2-甲基-3-丁炔 2-甲基-3-丁炔 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离出的c(H+)=10-13mol•L溶液:Na+、NH4+、CO32-、SO42- | |
| B. | 澄清透明溶液:Mg2+、Cu2+、SO42-、Cl- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014溶液:Ba2+、Na+、ClO-、NO- |
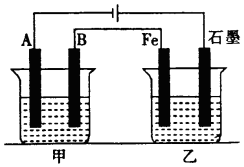 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: