题目内容
20.观察下列模型并结合有关信息,判断有关说法正确的是( )| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  | 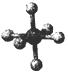 |  |  |
| 备注 | 熔点187K | 易溶于CS2 |
| A. | 单质硼属分子晶体,其结构单B12中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的极性分子 | |
| C. | 固态硫S8属于原子晶体 | |
| D. | NaCl晶体中每个Na+周围距离最近的Na+有6个 |
分析 A.根据图中硼的结构单元解题,每个B原子具有$\frac{1}{2}$×5个共价键,每个三角形中含有$\frac{1}{2}$×3个共价键;
B.不同非金属元素的原子之间形成极性键;
C.根据晶体中存在的微粒判断;
D.氯化钠为离子化合物,NaCl晶胞中每个Na+周围最近且等距离的Na+有12个.
解答 解:A.单质硼属于原子晶体,由图知,每个B原子具有$\frac{1}{2}$×5个共价键,12个B原子共含有12×$\frac{1}{2}$×5=30个共价键,含有的三角形数目=30÷($\frac{1}{2}$×3)=20,故A正确;
B.SF6空间构型为对称结构分子极性抵消,正负电荷的重心重合,电荷分布均匀,SF6为非极性分子,故B错误;
C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故C错误;
D、氯化钠为离子化合物,NaCl熔化和溶于水均能产生自由移动的离子,且破坏的都是离子键,NaCl晶胞中每个Na+周围最近且等距离的Na+有12个,故D错误;
故选A.
点评 本题考查晶体结构的分析,为高频考点,侧重考查学生的分析能力,注意根据均摊法进行分析解答即可,难点是选项A,题目难度中等.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.80℃时,2L密闭容器中充入0.40mol N2O4,发生反应:N2O4(g)?2NO2(g)△H=+53kJ•mol-1,获得如下数据:下列判断正确的是( )
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| c(NO2)/mol•L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
| A. | 20~40s内,v(N2O4)=0.004mol/(L•s) | |
| B. | 在相同条件下,开始时若向容器中充入的是0.80 molNO2,达到平衡后NO2的转化率为75% | |
| C. | 反应达平衡时,吸收的热量为15.9 kJ | |
| D. | 100 s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大 |
5.浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是( )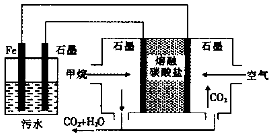

| A. | Fe电极的电极反应式为:Fe-2e-═Fe2+ | |
| B. | 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32- | |
| C. | 通入甲烷的石墨电极的电极反应式为:CH4+100H+-8e-═CO32-+7H2O | |
| D. | 为增强污水的导电能力,可向污水中加入适量工业用食盐 |
12. 是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
 是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )
是烯烃与H2加成后的产物,则该烯烃的结构简式可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
9.下列事实或现象及结论均正确的是( )
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
20.化学与生活息息相关.下列说法正确的是( )
| A. | 加活性炭吸附水中小顆粒物,净化水质的方法属于物理方法 | |
| B. | 医用消毒洒精中乙醇的浓度为95% | |
| C. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝“是指硝酸 |
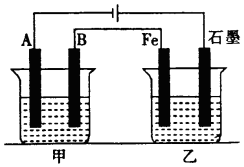 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答(1)~(3)小题: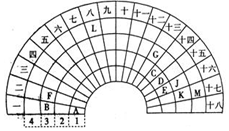 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题: .
. .
.