题目内容
根据已具备的氧化还原反应知识和电学知识,利用提供的实验Hj品按照题意要求设计一套电池装置.提供的,用品:锌片、铁片、铜片、碳(石墨)棒、导线、金属夹、手电筒用小灯泡、稀H2SO4溶液、AgNO3溶液、250mL烧杯、酒精灯、玻璃棒等.
(1)当选择用AgNO3溶液作为电解质溶液时,由以上提供的用品能组装成套电池,以上电池正极上的反应均相同,写出极上的反应式:
(2)选择稀H2SO4作为电解质溶液,其它用品自选,设计一套能表明电路中有电流产生的电池装置,在右边画出你设计的装置简图;
(3)根据你设计的装置简图同答下列问题:
①负极是 ,发生 (填“氧化”或“还原”)反应,电极反应式为: ;
②正极上能观察到的现象是 ;
③电子流动的方向是 .
(1)当选择用AgNO3溶液作为电解质溶液时,由以上提供的用品能组装成套电池,以上电池正极上的反应均相同,写出极上的反应式:
(2)选择稀H2SO4作为电解质溶液,其它用品自选,设计一套能表明电路中有电流产生的电池装置,在右边画出你设计的装置简图;
(3)根据你设计的装置简图同答下列问题:
①负极是
②正极上能观察到的现象是
③电子流动的方向是
考点:设计原电池
专题:电化学专题
分析:(1)根据原电池工作原理,电解质溶液为硝酸银溶液,阴离子在正极得到电子生成单质银,据此写出反应的电极反应;
(2)根据原电池构成条件选择电极材料,然后画出原电池的装置简图;
(3)①原电池负极发生发生氧化反应,锌失去电子生成锌离子;
②正极发生还原反应,溶液中的氢离子得到电子失去氢气;
③电子流到方向与电流方向相反.
(2)根据原电池构成条件选择电极材料,然后画出原电池的装置简图;
(3)①原电池负极发生发生氧化反应,锌失去电子生成锌离子;
②正极发生还原反应,溶液中的氢离子得到电子失去氢气;
③电子流到方向与电流方向相反.
解答:
解:(1)当选择用AgNO3溶液作为电解质溶液时,无论选择何种材料为电极,构成的原电池中,正极发生的反应都是银离子得到电子,电极反应为:Ag++e-=Ag↓,
故:原电池的正负反应为:Ag++e-=Ag↓;
(2)硫酸为电解质溶液,可以选择锌和铜为电解,构成的原电池装置简图为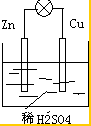 ,
,
答:以硫酸为电解质溶液的原电池装置图为 ;
;
(3)①负极金属锌失去电子生成锌离子,发生了氧化反应,电极反应式为:Zn-2e-=Zn2+,
故答案为:锌(电极);氧化; Zn-2e-=Zn2+;
②该原电池的正极氢离子得到电子生成了氢气,所以正极现象为:铜片上有气泡产生,但铜不溶解,
故答案为:铜片上有气泡产生,但铜不溶解;
③原电池中电流方向为正极流向负极,该原电池中锌为负极,铜为正极,电子流动方向与电流方向相反,电子由负极锌片上流出,经导线、小灯泡流入正极铜片上,
故答案为:电子由负极锌片上流出,经导线、小灯泡流入正极铜片上.
故:原电池的正负反应为:Ag++e-=Ag↓;
(2)硫酸为电解质溶液,可以选择锌和铜为电解,构成的原电池装置简图为
 ,
,答:以硫酸为电解质溶液的原电池装置图为
 ;
;(3)①负极金属锌失去电子生成锌离子,发生了氧化反应,电极反应式为:Zn-2e-=Zn2+,
故答案为:锌(电极);氧化; Zn-2e-=Zn2+;
②该原电池的正极氢离子得到电子生成了氢气,所以正极现象为:铜片上有气泡产生,但铜不溶解,
故答案为:铜片上有气泡产生,但铜不溶解;
③原电池中电流方向为正极流向负极,该原电池中锌为负极,铜为正极,电子流动方向与电流方向相反,电子由负极锌片上流出,经导线、小灯泡流入正极铜片上,
故答案为:电子由负极锌片上流出,经导线、小灯泡流入正极铜片上.
点评:本题考查了原电池的设计、原电池工作原理及电极反应的书写,题目难度中等,注意明确原电池工作原理、掌握电极反应式的书写方法,能够根据要求画出原电池装置简图.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中所含分子数最多的是( )
| A、1.5molO2 |
| B、56gN2 |
| C、标准状况下22.4LCl2 |
| D、3.01×1023个硫酸分子 |
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH=13的溶液:K+、Fe2+、SO42-、NO3- |
| B、能使淀粉碘化钾试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、加入铝粉有大量氢气放出的溶液:Ba2+、NH4+、NO3- |
| D、加入镁条有氢气放出的溶液:Na+、NH4+、Cl-、SO42- |
下列离子方程式的书写正确的是( )
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B、金属铁溶于盐酸中:Fe+2H+=Fe3++H2↑ |
| C、氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| D、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
等物质的量的下列有机物在氧气中充分燃烧,消耗氧气最多的是( )
| A、甲酸甲酯(HCOOCH3) |
| B、乙醛 |
| C、乙酸 |
| D、乙醇 |
NA为阿伏伽德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L水含有的水分子数为NA |
| B、常温常压下,22 g CO2含有的CO2分子数为0.5NA |
| C、标准状况下,1 mol CH4分子的电子数为8 NA |
| D、物质的量浓度为1mol/L的AlCl3溶液中,Cl- 的物质的量浓度为1mol/L |
 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图,计算(1)a处沉淀的总物质的量
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图,计算(1)a处沉淀的总物质的量