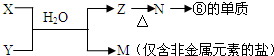题目内容
16.(1)鉴别NaCl溶液和Na2CO3溶液的试剂是稀盐酸,离子方程式为CO32-+2H+=CO2↑+H2O.(2)除去混在NaCl溶液中少量NaHCO3杂质的试剂是稀盐酸,离子方程式为HCO3-+H+=CO2↑+H2O.
(3)除去Na2CO3粉末中混入的NaHCO3杂质用加热、方法,化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 (1)碳酸钠与盐酸反应生成二氧化碳气体,氯化钠与盐酸不反应;
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
(3)碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳.
解答 解:(1)碳酸钠与盐酸反应生成二氧化碳气体,氯化钠与盐酸不反应,反应离子方程式:CO32-+2H+=CO2↑+H2O;所以可以用稀盐酸鉴别氯化钠与碳酸钠溶液;
故答案为:稀盐酸、CO32-+2H+=CO2↑+H2O;
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式:HCO3-+H+=CO2↑+H2O;所以可以用稀盐酸除去氯化钠中少量的碳酸氢钠;
故答案为:稀盐酸、HCO3-+H+=CO2↑+H2O;
(3)碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳,化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;故用加热方法可以除去碳酸钠中的碳酸氢钠;
故答案为:加热、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查了物质的鉴别与除杂,侧重离子方程式、化学方程式的书写,明确物质的性质及发生反应的实质即可解答,注意除杂时不能引入新的杂质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列化学用语书写正确的是( )
| A. | 四氯化碳的电子式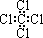 | B. | 环丙烷的最简式CH2 | ||
| C. | 甲醛的结构式HCHO | D. | S2-的最外层电子排布式3s23p4 |
1.经测量a滴水的体积为bmL,则1滴水中所含的分子数为( )
| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
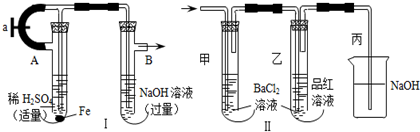
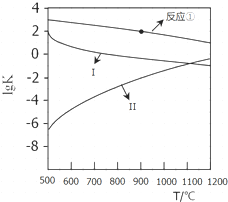 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
.
 .
.