题目内容
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、标况下,22.4L CH3Cl和CH2Cl2的混合物所含氯原子数介于NA至2NA之间 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.过氧化钠中氧元素为-1价,根据过氧化钠与水反应生成氧气的物质的量计算出转移的电子数;
B.金刚石中C原子与其它4个C形成4个碳碳键,根据均摊法计算出12g金刚石中含有的共价键数目;
C.0.1mol铜完全反应失去0.2mol电子,根据电子守恒计算出生成二氧化硫的物质的量及标况下体积;
D.标况下二氯甲烷的状态不是气体,不能使用标况下的气体摩尔体积计算二氯甲烷的物质的量.
B.金刚石中C原子与其它4个C形成4个碳碳键,根据均摊法计算出12g金刚石中含有的共价键数目;
C.0.1mol铜完全反应失去0.2mol电子,根据电子守恒计算出生成二氧化硫的物质的量及标况下体积;
D.标况下二氯甲烷的状态不是气体,不能使用标况下的气体摩尔体积计算二氯甲烷的物质的量.
解答:
解:A.0.1mol过氧化钠与足量水反应生成0.05mol氧气,转移了0.1mol电子,转移电子数目为0.1NA,故A错误;
B.12g金刚石中含有1molC,1molC与其它4molC形成4mol碳碳键,形成的共价键的物质的量为:4mol×
=2mol,含有的共价键数为2NA,故B正确;
C.生成1mol二氧化硫需要得到2mol电子,0.1mol铜完全反应失去0.2mol电子,完全反应可以生成0.1mol二氧化硫,在标况下0.1mol二氧化硫的体积约为2.24L,故C正确;
D.标准状况下,二氯甲烷的状态不是气体,题中条件无法计算混合物的物质的量,故D错误;
故选D.
B.12g金刚石中含有1molC,1molC与其它4molC形成4mol碳碳键,形成的共价键的物质的量为:4mol×
| 1 |
| 2 |
C.生成1mol二氧化硫需要得到2mol电子,0.1mol铜完全反应失去0.2mol电子,完全反应可以生成0.1mol二氧化硫,在标况下0.1mol二氧化硫的体积约为2.24L,故C正确;
D.标准状况下,二氯甲烷的状态不是气体,题中条件无法计算混合物的物质的量,故D错误;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为难点,注意掌握均摊法的应用,选项D为易错点,注意二氯甲烷在标况下不是气体.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值下列叙述正确的是( )
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A、含4 mol Si-O键的二氧化硅晶体中,氧原子数为2NA |
| B、1.8 g重水(D2O)中含有的质子数和电子数均为NA |
| C、1 L 1mol?L-1的CH3COONa溶液中含有CH3COO-的数目为NA |
| D、将11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5 NA |
用下列实验装置进行相应实验,能达到实验目的是( )
A、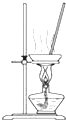 如图所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
B、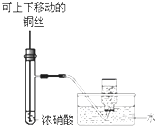 如图所示装置,制备并收集少量NO2气体 |
C、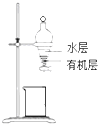 如图所示装置,分离CCl4萃取I2水后的有机层和水层 |
D、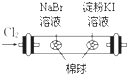 如图所示装置,可以证明氧化性:Cl2>Br2>I2 |
下列离子方程式正确的是( )
| A、氯气与水反应Cl2+H20═2H++Cl-+ClO- |
| B、将铝粉投入氧氧化钠离溶液中:2Al+20H-═2AlO2-+H2↑ |
| C、金属钠与水反应:2Na+2H20═2Na++20H-+H2↑ |
| D、氯化铝溶液与过量氨水反应Al3++4NH3?H2O═Al02-+4NH4++2H20 |
下列反应的离子方程式不正确的是( )
| A、铁和稀盐酸反应:Fe+2H+═Fe2++H2↑ |
| B、碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、硫酸溶液中加入碳酸氢钠溶液:H++HCO3-═CO2↑+H2O |
| D、在氢氧化钾的稀溶液中通过量的二氧化碳气体:CO2+OH-═HCO3- |
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,0.1NA个乙炔分子完全燃烧需要的O2的体积约为11.2L |
| B、标准状况下,11.2L乙烯分子中含有的碳碳共用电子对数目为0.5NA |
| C、15g乙烷分子中含有的碳氢键数目为3NA |
| D、常温常压下,1 mol氦气含有的核外电子数为4 NA |