题目内容
下列反应的离子方程式不正确的是( )
| A、铁和稀盐酸反应:Fe+2H+═Fe2++H2↑ |
| B、碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、硫酸溶液中加入碳酸氢钠溶液:H++HCO3-═CO2↑+H2O |
| D、在氢氧化钾的稀溶液中通过量的二氧化碳气体:CO2+OH-═HCO3- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.反应生成氯化亚铁和氢气;
B.醋酸在离子反应中保留化学式;
C.反应生成硫酸钠、水、二氧化碳;
D.反应生成碳酸氢钾.
B.醋酸在离子反应中保留化学式;
C.反应生成硫酸钠、水、二氧化碳;
D.反应生成碳酸氢钾.
解答:
解:A.铁和稀盐酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A正确;
B.碳酸钙溶于醋酸溶液的离子反应为CaCO3+2HAc═Ca2++CO2↑+H2O+2Ac-,故B错误;
C.硫酸溶液中加入碳酸氢钠溶液的离子反应为H++HCO3-═CO2↑+H2O,故C正确;
D.在氢氧化钾的稀溶液中通过量的二氧化碳气体的离子反应为CO2+OH-═HCO3-,故D正确;
故选B.
B.碳酸钙溶于醋酸溶液的离子反应为CaCO3+2HAc═Ca2++CO2↑+H2O+2Ac-,故B错误;
C.硫酸溶液中加入碳酸氢钠溶液的离子反应为H++HCO3-═CO2↑+H2O,故C正确;
D.在氢氧化钾的稀溶液中通过量的二氧化碳气体的离子反应为CO2+OH-═HCO3-,故D正确;
故选B.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 配制100mL 0.1mol?L-1的硫酸 |
B、 吸收氨气并防止倒吸 |
C、 制取少量乙烯气体 |
D、 验证溴乙烷发生消去反应 |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、标况下,22.4L CH3Cl和CH2Cl2的混合物所含氯原子数介于NA至2NA之间 |
下列物质的分类全部正确的是( )
| A、NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 |
| B、汽油-混合物 胆矾-纯净物 金刚石-单质 |
| C、纯碱-碱 硫化氢-酸 小苏打-酸式盐 |
| D、液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
下列变化可通过一步化学反应实现的是( )
| A、S→S03 |
| B、Al203→Al( OH)3 |
| C、Si02→H2SiO3 |
| D、Na2CO3→NaOH |
下列对各种平衡体系的叙述中,不正确的是( )
| A、一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、某温度下,容积一定的密闭容器中进行可逆反应,X(g)+Y(g)?2Z(g)+W(s)△H>0平衡后,升高温度,c(Z)增大 |
| C、常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡正向移动 |
| D、在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、澄清透明的溶液中:H+、Fe2+、SO42-、NO3- |
| B、使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- |
| C、0.1 mol?L-1的BaCl2溶液中:K+、Na+、OH-、NO3- |
| D、由水电离出的c(H+)=10-12 mol?L-1的溶液中:Mg2+、K+、Br-、HCO3- |
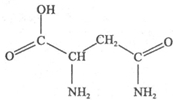 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.