题目内容
X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z最外层电子数之和为10,下列说法正确的是( )
| A、Y的最高价氧化物对应的水化物一定是碱 |
| B、稳定性:W的氢化物>Z的氢化物,沸点:W的氢化物<Z的氢化物 |
| C、若X、Y、W形成的化合物为XYW2,则其水溶液显酸性 |
| D、X、Y的氧化物晶体类型不一定相同 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,则W应位于第二周期,X、Y、Z位于第三周期,且X、Y、Z最外层电子数之和为10,则最外层电子数可分别为1、2、7;1、3、6;1、4、5;或2、3、5等,以此确定元素的种类,结合元素周期律知识解答该题.
解答:
解:X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,则W应位于第二周期,X、Y、Z位于第三周期,且X、Y、Z最外层电子数之和为10,则最外层电子数可分别为1、2、7;1、3、6;1、4、5;或2、3、5等,
A.如X、Y、Z最外层电子数分别为1、3、6,则Y为Al,对应的最高价氧化物的水化物为弱碱,如为1、4、5,则Y为Si,对应的最高价氧化物的水化物为弱酸,故A错误;
B.Z、W处于同一主族,元素的非金属性Z<W,稳定性:W的氢化物>Z的氢化物,如Z为O或F,则对应的氢化物含有氢键,沸点高,故B错误;
C.若X、Y、W形成的化合物为XYW2,应为NaAlO2,水解呈碱性,故C错误;
D.如最外层电子数分别为1、4、5,则X、Y的氧化物分别为离子化合物和原子化合物,不相同,故D正确.
故选D.
A.如X、Y、Z最外层电子数分别为1、3、6,则Y为Al,对应的最高价氧化物的水化物为弱碱,如为1、4、5,则Y为Si,对应的最高价氧化物的水化物为弱酸,故A错误;
B.Z、W处于同一主族,元素的非金属性Z<W,稳定性:W的氢化物>Z的氢化物,如Z为O或F,则对应的氢化物含有氢键,沸点高,故B错误;
C.若X、Y、W形成的化合物为XYW2,应为NaAlO2,水解呈碱性,故C错误;
D.如最外层电子数分别为1、4、5,则X、Y的氧化物分别为离子化合物和原子化合物,不相同,故D正确.
故选D.
点评:本题考查原子结构与元素周期律,为高频考点,侧重于学生的分析能力的考查,注意把握原子结构和元素周期表的特点,难度中等.

练习册系列答案
相关题目
某密闭容器中放入一定量的NO2,发生反应2NO2(g)?N2O4(g)(正反应放热),达平衡后,若分别单独改变下列条件,重新达到平衡后,能使混和气体平均分子量增大的是( )
①通入N2 ②通入NO2 ③通入N2O4 ④升高温度.
①通入N2 ②通入NO2 ③通入N2O4 ④升高温度.
| A、①② | B、③④ | C、②③ | D、②④ |
在一个2L的容器中,放入2mol气体A,5分钟后,测得这种气体A还剩余0.5mol,该反应中气体A的化学反应速率是( )
| A、1.5mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
常温下,下列各溶液的叙述不正确的是( )
| A、pH=7的氨水和氯化铵混合溶液中c(NH4+)=c(Cl-) |
B、浓度均为0.1mol?L-1的 溶液和CH3COONa溶液中,溶液中c( 溶液和CH3COONa溶液中,溶液中c( )<c(CH3COO-) )<c(CH3COO-) |
| C、pH=3的硫酸溶液和pH=11的氨水溶液等体积混合,混合后溶液显碱性 |
| D、已知酸性HF>CH3COOH,则等体积等物质的量浓度的NaF和CH3COONa溶液所含的阴离子数后者较多 |
将CO2转化成有机物可有效实现碳循环.下列反应中,最节能的是( )
A、CO2+3H2
| |||
B、6CO2+6H2O
| |||
C、CO2+CH4
| |||
D、2CO2+6H2
|
下列反应中不属于氧化还原反应的是( )
| A、Cl2+2NaOH═NaCl+NaClO+H2O |
| B、NH3+HCl═NH4Cl |
| C、Br2+2KI═I2+2KBr |
| D、CO2+Ca(OH)2═CaCO3+H2O |
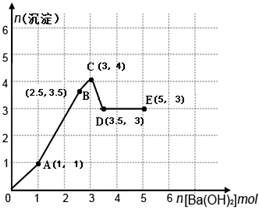 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A、O→A:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| B、A→B:2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、B→C:2NH4++SO42-+Ba2++2OH-→BaSO4↓+2NH3?H2O |
| D、D→E:NH4++OH-→NH3?H2O |