��Ŀ����
������ʯ��һ������������³���ֵĿ��������Ҫ�ɷ���NaNO3����ҵ�ϴ�������ʯ����ȡNaNO3��Ϊ�˲ⶨһ����������Ʒ�Ĵ��ȣ�������������Һ�м��ȸû������뺬���ĺϽ𣮸÷�Ӧ���ɵİ����ڼ��ȵ��������ݳ������ܽ������У�
3NaNO3��aq��+8Al��s��+5NaOH��aq��+18H2O��I����3NH3��g��+8NaAl��OH��4��aq��
���ɵİ���������֪Ũ�ȵĹ��������У�
2NH3+H2SO4����NH4��2SO4
ʣ������������ͨ������֪Ũ�ȵ�����������Һ��Ӧ����ã�
H2SO4+2NaOH��Na2SO4+2H2O
��1��1.64g������NaNO3��Ʒ����������Ͻ�Ӧ�����ɵİ����ܽ���25.0mL 1.00mol/L��H2SO4�У������еİ������ܽ⣬ʣ���������16.2mL 2.00mol/L��NaOH��Һǡ����ȫ��Ӧ��
�ټ���25.0mL 1.00mol/L��H2SO4�У�H2SO4�����ʵ�����
�ڼ���16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ�����
�ۼ���������������Һ��Ӧ����������ʵ�����
�ܼ����백����Ӧ����������ʵ�����
�ݼ��������ᷴӦ�İ��������ʵ�����
�����뺬���ĺϽ�Ӧ�������Ƶ����ʵ�����
���㷴Ӧ�������Ƶ�������
�������Ʒ�������Ƶ������ٷ�����
��2��������Ʒ�����ķ�Ӧ��������ԭ��Ӧ�������ƺͰ�����NԪ�صĻ��ϼ۷ֱ��ǣ�NaNO3 ��NH3 ��
3NaNO3��aq��+8Al��s��+5NaOH��aq��+18H2O��I����3NH3��g��+8NaAl��OH��4��aq��
���ɵİ���������֪Ũ�ȵĹ��������У�
2NH3+H2SO4����NH4��2SO4
ʣ������������ͨ������֪Ũ�ȵ�����������Һ��Ӧ����ã�
H2SO4+2NaOH��Na2SO4+2H2O
��1��1.64g������NaNO3��Ʒ����������Ͻ�Ӧ�����ɵİ����ܽ���25.0mL 1.00mol/L��H2SO4�У������еİ������ܽ⣬ʣ���������16.2mL 2.00mol/L��NaOH��Һǡ����ȫ��Ӧ��
�ټ���25.0mL 1.00mol/L��H2SO4�У�H2SO4�����ʵ�����
�ڼ���16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ�����
�ۼ���������������Һ��Ӧ����������ʵ�����
�ܼ����백����Ӧ����������ʵ�����
�ݼ��������ᷴӦ�İ��������ʵ�����
�����뺬���ĺϽ�Ӧ�������Ƶ����ʵ�����
���㷴Ӧ�������Ƶ�������
�������Ʒ�������Ƶ������ٷ�����
��2��������Ʒ�����ķ�Ӧ��������ԭ��Ӧ�������ƺͰ�����NԪ�صĻ��ϼ۷ֱ��ǣ�NaNO3
���㣺̽�����ʵ���ɻ�������ʵĺ���,��ѧ����ʽ���йؼ���
ר�⣺������
��������1����25.0mL 1.00mol/L��H2SO4�У�H2SO4�����ʵ���=CV����õ���
��16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ���=CV����õ���
��������������Һ��Ӧ����������ʵ��������ݻ�ѧ��Ӧ������ϵ���㣬��ʣ���������16.2mL 2.00mol/L��NaOH��Һǡ����ȫ��Ӧ���㣻
�����ɵİ����ܽ���25.0mL 1.00mol/L��H2SO4�У���ϰ��������ᷴӦ������ϵ���㣻
�ݽ�Ϣܼ��������ᷴӦ�İ��������ʵ������㣻
���������ɰ�����ϻ�ѧ����ʽ������ϵ�����뺬���ĺϽ�Ӧ�������Ƶ����ʵ�����
������n=
���������Ħ����������������
����������������=
��100%��
��2�����ݻ�ѧʽ��Ԫ�ػ��ϼ۴�����Ϊ0�����עԪ�ػ��ϼۣ�
��16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ���=CV����õ���
��������������Һ��Ӧ����������ʵ��������ݻ�ѧ��Ӧ������ϵ���㣬��ʣ���������16.2mL 2.00mol/L��NaOH��Һǡ����ȫ��Ӧ���㣻
�����ɵİ����ܽ���25.0mL 1.00mol/L��H2SO4�У���ϰ��������ᷴӦ������ϵ���㣻
�ݽ�Ϣܼ��������ᷴӦ�İ��������ʵ������㣻
���������ɰ�����ϻ�ѧ����ʽ������ϵ�����뺬���ĺϽ�Ӧ�������Ƶ����ʵ�����
������n=
| m |
| M |
����������������=
| ���������� |
| ��Ʒ���� |
��2�����ݻ�ѧʽ��Ԫ�ػ��ϼ۴�����Ϊ0�����עԪ�ػ��ϼۣ�
���
�⣺��1����25.0mL 1.00mol/L��H2SO4�У�H2SO4�����ʵ���=CV=0.0250L��1.00mol/L=0.02500mol��
��25.0mL 1.00mol/L��H2SO4�У�H2SO4�����ʵ���Ϊ0.02500mol��
��16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ���=CV=0.0162L��2.00mol/L��=0.0324mol��
��16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ���Ϊ0.0324mol��
��������������Һ��Ӧ����������ʵ��������ݻ�ѧ��Ӧ������ϵ���㣬��ʣ���������16.2mL 2.00mol/L��NaOH��Һǡ����ȫ��Ӧ����
H2SO4+2NaOH=Na2SO4+2H2O��
1 2
n 0.034mol
n=0.0162mol��
��������������Һ��Ӧ����������ʵ���Ϊ0.0162mol��
�����ɵİ����ܽ���25.0mL 1.00mol/L��H2SO4�У�0.0250L��1.00mol/L-0.0162mol=0.0088mol��
���백����Ӧ����������ʵ���Ϊ0.0088mol��
��2NH3+H2SO4=��NH3��2SO4��
2 1
n 0.0250L��1.00mol/L-0.0162mol
n=0.0176mol��
�𣺼��������ᷴӦ�İ��������ʵ���Ϊ0.0176mol��
���������ɰ�����ϻ�ѧ����ʽ������ϵ�����뺬���ĺϽ�Ӧ�������Ƶ����ʵ�����
3NaNO3��aq��+8Al��s��+5NaOH��aq��+18H2O��I����3NH3��g��+8NaAl��OH��4��aq��
3 5 3
n 0.0176mol
n=0.0176mol��
���뺬���ĺϽ�Ӧ�������Ƶ����ʵ���Ϊ0.0176mol��
������n=
���������Ħ��������������=0.0176mol��85g/mol=1.496g��
�𣺷�Ӧ�������Ƶ�����Ϊ1.496g��
����������������=
��100%=
��100%=91.2%��
����Ʒ�������Ƶ������ٷ���Ϊ91.2%��
��2�����ݻ�ѧʽ��Ԫ�ػ��ϼ۴�����Ϊ0�����עԪ�ػ��ϼۣ������ƺͰ�����NԪ�صĻ��ϼ۷ֱ���+5�ۣ�-3�ۣ�
�ʴ�Ϊ��+5��-3��
��25.0mL 1.00mol/L��H2SO4�У�H2SO4�����ʵ���Ϊ0.02500mol��
��16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ���=CV=0.0162L��2.00mol/L��=0.0324mol��
��16.2mL 2.00mol/L��NaOH��Һ�У�NaOH�����ʵ���Ϊ0.0324mol��
��������������Һ��Ӧ����������ʵ��������ݻ�ѧ��Ӧ������ϵ���㣬��ʣ���������16.2mL 2.00mol/L��NaOH��Һǡ����ȫ��Ӧ����
H2SO4+2NaOH=Na2SO4+2H2O��
1 2
n 0.034mol
n=0.0162mol��
��������������Һ��Ӧ����������ʵ���Ϊ0.0162mol��
�����ɵİ����ܽ���25.0mL 1.00mol/L��H2SO4�У�0.0250L��1.00mol/L-0.0162mol=0.0088mol��
���백����Ӧ����������ʵ���Ϊ0.0088mol��
��2NH3+H2SO4=��NH3��2SO4��
2 1
n 0.0250L��1.00mol/L-0.0162mol
n=0.0176mol��
�𣺼��������ᷴӦ�İ��������ʵ���Ϊ0.0176mol��
���������ɰ�����ϻ�ѧ����ʽ������ϵ�����뺬���ĺϽ�Ӧ�������Ƶ����ʵ�����
3NaNO3��aq��+8Al��s��+5NaOH��aq��+18H2O��I����3NH3��g��+8NaAl��OH��4��aq��
3 5 3
n 0.0176mol
n=0.0176mol��
���뺬���ĺϽ�Ӧ�������Ƶ����ʵ���Ϊ0.0176mol��
������n=
| m |
| M |
�𣺷�Ӧ�������Ƶ�����Ϊ1.496g��
����������������=
| ���������� |
| ��Ʒ���� |
| 1.496g |
| 1.64g |
����Ʒ�������Ƶ������ٷ���Ϊ91.2%��
��2�����ݻ�ѧʽ��Ԫ�ػ��ϼ۴�����Ϊ0�����עԪ�ػ��ϼۣ������ƺͰ�����NԪ�صĻ��ϼ۷ֱ���+5�ۣ�-3�ۣ�
�ʴ�Ϊ��+5��-3��
���������⿼�����������ʵķ������㣬��Ӧ���̵�����Ӧ�ã�ע�����ʷ�Ӧ�������̵��жϣ����ջ����ǹؼ�����Ŀ�ϼ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
���ʵ�����ȵ�Na2CO3�� NaHCO3�ֱ������������ᷴӦ���õ�CO2�����ʵ���֮��Ϊ��������
| A��1��1 | B��2��1 |
| C��1��2 | D��1��3 |
���й���Ӫ�����ʵ�˵����ȷ���ǣ�������
| A�����ࡢ��֬�������ʶ��ܷ���ˮ�ⷴӦ |
| B�����ࡢ��֬�������ʶ�����C��H��O����Ԫ����ɵ� |
| C�����ࡢ��֬�������ʶ��Ǹ߷��ӻ����� |
| D����֬���ͺ�֬��֮�֣��������� |
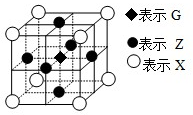 ��֪��E��G��Q��R��T��X��Y��Z�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵������������E�ļ��������������2�����ӣ�Gԭ���������������ڲ��������������XԪ�����������������ڲ��������ͬ��T2R�ľ������������Ӿ��壬Yԭ�ӻ�̬3pԭ�ӹ������2��δ�ɶԵ��ӣ��䵥�ʾ�����������ԭ�Ӿ��壻��Ԫ�����ڱ���ZԪ��λ�ڵ�10�У�
��֪��E��G��Q��R��T��X��Y��Z�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵������������E�ļ��������������2�����ӣ�Gԭ���������������ڲ��������������XԪ�����������������ڲ��������ͬ��T2R�ľ������������Ӿ��壬Yԭ�ӻ�̬3pԭ�ӹ������2��δ�ɶԵ��ӣ��䵥�ʾ�����������ԭ�Ӿ��壻��Ԫ�����ڱ���ZԪ��λ�ڵ�10�У� ����ͼ��ʾ��ʵ��װ�ý���ʵ��X��Yʱ��ÿ������ӷֱ�ⶨ�ų���������������ѡ���п���ȷ��ʾʵ��X��Y�Ľ���ǣ�������
����ͼ��ʾ��ʵ��װ�ý���ʵ��X��Yʱ��ÿ������ӷֱ�ⶨ�ų���������������ѡ���п���ȷ��ʾʵ��X��Y�Ľ���ǣ�������


