题目内容
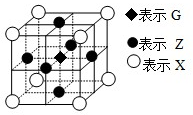 已知:E、G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.E的简单阴离子最外层有2个电子,G原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同.T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
已知:E、G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.E的简单阴离子最外层有2个电子,G原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同.T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.回答下列问题:
(1)基态R原子的电子排布图(即轨道表示式)是
(2)YR2晶体中,Y原子采取
(3)分子式为G2E6R的物质有两种,其中一种易溶于水,原因是
(4)据报道,由G、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示.则该晶体的化学式为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:E、G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.E的简单阴离子最外层有2个电子,则E为氢元素;G原子最外层电子数是内层电子数的两倍,则G原子有2个电子层,最外层电子数为4,故G为碳元素;X元素最外层电子数与最内层电子数相同,原子序数大于碳元素,最外层电子数为2,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Q的原子序数在C与O之间,则G为N元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第10列,则Z为Ni元素,据此解答.
解答:
解:E、G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.E的简单阴离子最外层有2个电子,则E为氢元素;G原子最外层电子数是内层电子数的两倍,则G原子有2个电子层,最外层电子数为4,故G为碳元素;X元素最外层电子数与最内层电子数相同,原子序数大于碳元素,最外层电子数为2,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Q的原子序数在C与O之间,则G为N元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第10列,则Z为Ni元素,
(1)R为O元素,原子核外电子数为8,基态O原子的电子排布图: ,
,
故答案为: ;
;
(2)SiO2晶体中Si原子与O原子形成4个共价键,则Si为sp3杂化,NO2+与CO2是等电子体,二者结构相似,则电子式为[:
::N::
:]+;
故答案为:sp3;[:
::N::
:]+;
(3)分子式为C2H6O的物质有两种,其中一种易溶于水,该物质为乙醇,由于乙醇分子与水分子形成氢键,故易溶于水,
故答案为:乙醇分子与水分子形成氢键;
(4)由C、Mg、Ni三种元素形成的一种晶体具有超导性,其晶体结构如下图所示,每个晶胞含有一个Mg,含有Ni个数为:6×
=3,含有C个数为:8×
=1,故该晶体的化学式为:MgCNi3;利用均摊法确定G原子个数,每个X原子被两个晶胞共用,每个晶胞含有一个G原子,所以晶体中距每个X原子周围距离最近的G原子有2个,
故答案为:MgCNi3;2.
(1)R为O元素,原子核外电子数为8,基态O原子的电子排布图:
 ,
,故答案为:
 ;
;(2)SiO2晶体中Si原子与O原子形成4个共价键,则Si为sp3杂化,NO2+与CO2是等电子体,二者结构相似,则电子式为[:
| ?? |
| O |
| ?? |
| O |
故答案为:sp3;[:
| ?? |
| O |
| ?? |
| O |
(3)分子式为C2H6O的物质有两种,其中一种易溶于水,该物质为乙醇,由于乙醇分子与水分子形成氢键,故易溶于水,
故答案为:乙醇分子与水分子形成氢键;
(4)由C、Mg、Ni三种元素形成的一种晶体具有超导性,其晶体结构如下图所示,每个晶胞含有一个Mg,含有Ni个数为:6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:MgCNi3;2.
点评:本题考查位置结构性质关系、核外电子排布规律、杂化理论、等电子体、氢键、晶胞计算等,题目较为综合,推断元素是解题的关键,难度中等,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法不正确的是( )
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单 一材料 |
| C、光导纤维是以二氧化硅为主要原料制成的 |
| D、合成纤维的主要原料是石油、天然气、煤等 |
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、少量CO2通入硅酸钠溶液中:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
| C、含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、硫化钠水溶液呈碱性:S2-+2H2O?H2S+2OH- |
 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体.x为周期表前四周期中电负性最小的元素,Z的原子序数为28.