题目内容
现有一块铝铁合金,欲测定其铝的质量分数,切下W g合金,溶液盐酸中,再加入过量的NaOH溶液,滤出沉淀,将沉淀在空气中充分灼烧,最后得到W g红棕色粉末.则此合金中铝的质量分数为 .
考点:有关混合物反应的计算
专题:计算题
分析:w g铝铁合金粉末溶于盐酸中,加入过量NaOH 溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到红棕色粉末为氧化铁,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.
解答:
解:由铝铁合金粉末溶于足量盐酸中,加入过量NaOH 溶液,过滤后向滤液中通入足量二氧化碳,沉淀为氢氧化铝,则经洗涤、干燥、灼烧,得到的固体粉末是氧化铝,氧化铁质量等于合金的质量,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,则合金中Al的质量分数=氧化铁中氧的质量分数=
×100%=30%,
故答案为:30%.
| 16×3 |
| 160 |
故答案为:30%.
点评:本题考查混合物的有关计算,难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意铁元素的守恒.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
在一条件下,反应N2+3H2?2NH3在10L恒容密闭容器中进行,测得3min内,N2的物质的量由25mol减少到10mol,则3min内N2的化学反应速率为( )
| A、1.2mol?L-1?min-1 |
| B、1.0 mol?L-1?min-1 |
| C、0.5 mol?L-1?min-1 |
| D、0.4 mol?L-1?min-1 |
下列各类烃中,碳、氢两元素的质量比为一定值的是( )
| A、烷烃 | B、烯烃 | C、炔烃 | D、芳香烃 |
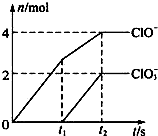 向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2
向一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中有三种含氯元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示.已知,生成ClO3-的反应为:6Ca(OH)2+6Cl2 
 其中F能与FeCl3溶液显紫色,I为一种不饱和酯.
其中F能与FeCl3溶液显紫色,I为一种不饱和酯.