题目内容
8.下列说法正确的是( )| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 升高温度正反应速率增大,则逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
分析 A.化学反应速率可表示可逆反应进行的快慢;
B.升高温度正逆反应速率都增大;
C.可逆反应的特征是正反应和逆反应都在同时发生,同时进行;
D.催化剂有正催化剂和负催化剂.
解答 解:A.化学反应速率可表示可逆反应进行的快慢,用单位时间内物质的量浓度变化量表示,化学平衡表示可逆反应进行的程度,故A错误;
B.升高温度增大活化分子百分数,则正逆反应速率都增大,故B正确;
C.可逆反应的特征是正反应和逆反应都在同时发生,同时进行,化学平衡状态的特征之一是正反应速率和逆反应速率相等的状态,故C错误;
D.负催化剂减慢化学反应速率,故D错误;
故选B.
点评 本题考查化学反应速率有关知识,为高频考点,明确化学反应速率影响原理、化学反应速率表示方法等知识点是解本题关键,易错选项是D.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
18.一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g)?2NH3 (g)测得0s到10s内,C(H2)减小了0.75mol/L,下列说法正确的是( )
| A. | 10s-15sC(NH3)增加量等于0.25 mol/L | |
| B. | 化学反应速率的关系是3v正(H2)=2v正(NH3) | |
| C. | 达到平衡后,分离出少量NH3,平衡正向移动,v正增大 | |
| D. | 保持压强不变充入Ar气体,v正减小 |
16.我国科学家屠哟哟因发现并提取青蒿素(化学式为C15H22O5)而获得2015年诺贝尔生理学奖或医学奖.她发现的青蒿素用以治疗疟疾,挽救了数百万患者的生命.下列关于青蒿素的叙述正确的是( )
| A. | 青蒿素属于烃 | B. | 青蒿素属于烷烃 | ||
| C. | 青蒿素属于无机化合物 | D. | 青蒿素属于有机化合物 |
3.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O)

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
请问答下列问题:
(1)滤渣A的主要成分为SiO2,滤渣B的主要成分为Fe(OH)3.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是过滤、洗涤、干燥.
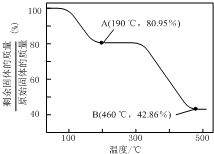
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑.

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2,滤渣B的主要成分为Fe(OH)3.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是过滤、洗涤、干燥.
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑.

13.下列方程式书写正确的是( )
| A. | 乙醇与金属钠反应产生氢气:CH3CH2OH+Na→CH3CH2ONa+H2↑ | |
| B. | 苯与浓硫酸、浓硝酸的混合溶液共热制硝基苯: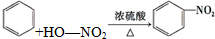 | |
| C. | 乙酸与乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2BrCH2Br |
20.下列物质中既含有离子键又含有共价键的是( )
| A. | Cl2 | B. | NaCl | C. | H2O | D. | NaOH |
17.硫酸工业是利用反应2SO2+O2?2SO3制备SO3,该反应为放热反应.温度和压强对SO2平衡转化率影响的数据如下表.
从成本角度考虑,应选用的适宜压强和温度条件是( )
| 压强/MPa | ||||
| SO2平衡 | ||||
| 转化率/% | ||||
| 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A. | 0.1 MPa,400℃ | B. | 0.5 MPa,500℃ | C. | 1 MPa,600℃ | D. | 10 MPa,600℃ |
18.下列说法正确的是( )
| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第二周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
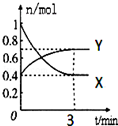 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.