题目内容
3.以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4•2H2O)
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2,滤渣B的主要成分为Fe(OH)3.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是过滤、洗涤、干燥.
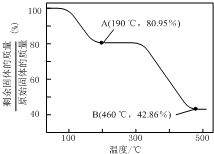
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑.
分析 用盐酸酸浸时SiO2不溶解,过滤分离,滤渣A为SiO2,滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤分离,滤液中再加入ZnS,Cu2+转化为CuS沉淀,过滤除去,滤液中注意为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等.
(1)由分析可知,滤渣A为二氧化硅,滤渣B为氢氧化铁;
(2)除锰过程中产生MnO(OH)2沉淀,根据电荷守恒应有氢离子生成;
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制pH使铁离子沉淀完全,而Zn2+不能沉淀;
②ZnS会将Fe3+还原为Fe2+,使铁元素难以除去;
(4)沉淀后要获得干燥纯净草酸锌晶体,需经过过滤、洗涤、干燥;
(5)ZnC2O4•2H2O晶体中的ZnC2O4质量分数为$\frac{153}{153+36}$×100%=80.95%,故A点完全失去结晶水,化学式为ZnC2O4,假设B点为ZnO,则残留固体占有的质量分数为$\frac{81}{153+36}$×100%=42.86%,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与CO2.
解答 解:用盐酸酸浸时SiO2不溶解,过滤分离,滤渣A为SiO2,滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤分离,滤液中再加入ZnS,Cu2+转化为CuS沉淀,过滤除去,滤液中注意为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等.
(1)由分析可知,滤渣A为SiO2,滤渣B为Fe(OH)3,
故答案为:SiO2;Fe(OH)3;
(2)除锰过程中产生MnO(OH)2沉淀,根据电荷守恒应有氢离子生成,反应离子方程式为:Mn2++H2O2+H2O=MnO(OH)2↓+2H+,
故答案为:Mn2++H2O2+H2O=MnO(OH)2↓+2H+;
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制pH使铁离子沉淀完全,而Zn2+不能沉淀,故控制反应液pH的范围为3.3~5.4,
故答案为:3.3~5.4;
②除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是:先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去,
故答案为:先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去;
(4)沉淀后要获得干燥纯净草酸锌晶体,需经过过滤、洗涤、干燥,
故答案为:过滤、洗涤、干燥;
(5)ZnC2O4•2H2O晶体中的ZnC2O4质量分数为$\frac{153}{153+36}$×100%=80.95%,故A点完全失去结晶水,化学式为ZnC2O4,假设B点为ZnO,则残留固体占有的质量分数为$\frac{81}{153+36}$×100%=42.86%,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与CO2.300℃~460℃范围内,发生反应的化学方程式为:ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑,
故答案为:ZnC2O4$\frac{\underline{\;△\;}}{\;}$ZnO+CO↑+CO2↑.
点评 本题考查物质制备工艺流程,关键是对工艺流程的理解,涉及陌生方程式书写、物质的分离提纯、对条件的控制与分析、化学计算等,是对学生综合能力的考查,是高考常考题目,熟练掌握元素化合物性质.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 为证明反应的发生,可取甲中溶液加入酸性高锰酸钾溶液 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 反应开始时,甲中石墨电极上Fe3+被还原 |
| A. | CO燃烧 | B. | H2SO4与NaOH反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 | D. | 生石灰与水作用 |
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 升高温度正反应速率增大,则逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
| A. | 标准状况下,1 mol SO3的体积为22.4 L | |
| B. | 4 g Ca变成Ca2+失去0.1NA个电子 | |
| C. | 1 mol CH4和1 mol O2质量相等 | |
| D. | 2 g H2中含有2 mol氢原子 |
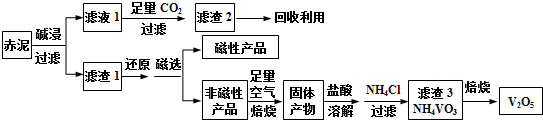
已知:钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O?VO3-+2H+.下列说法正确的是( )
| A. | 工业生产中,碱浸步骤可选用较为廉价的氨水 | |
| B. | 可以推测VO2Cl溶解度大于NH4VO3 | |
| C. | 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸以使其溶解完全 | |
| D. | 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见血红色,则磁性产品中一定不含铁元素 |
 .完成下列问题:
.完成下列问题: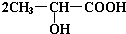 +Na2CO3→
+Na2CO3→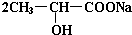 +H2O+CO2↑.
+H2O+CO2↑.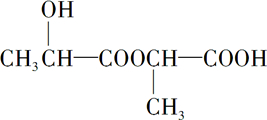 .
.