题目内容
19.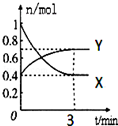 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.(1)曲线X(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线.
(2)若降低温度,则v(正)减慢,v(逆)减慢.(填“加快”或“减
慢”或“不变”).
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3mol/(L•s),乙中v(N2O4)=6mol/(L•min),则甲中反应更快.
(4)在0到3min中内N2O4的反应速率为0.05mol/(L•min).
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号)BCF;
A.v(NO2)=2v(N2O4)
B.容器内压强不再发生变化
C.X的体积分数不再发生变化
D.容器内气体原子总数不再发生变化
E.相同时间内消耗n mol的Y的同时生成2n mol的X
F.相同时间内消耗n mol的Y的同时消耗2n mol的X.
分析 (1)根据物质的量的变化量之比等于计量数之比分析;
(2)根据温度对反应速率的影响分析;
(3)根据反应速率之比等于化学计量数之比比较;
(4)根据v=$\frac{△c}{△t}$计算反应速率,结合图象计算相关物理量;
(5)根据可逆反应处于平衡状态时,正逆反应速率相等、组成不变等特征判断.
解答 解:(1)由方程式2NO2 (g) (红棕色)?N2O4(g)(无色),可知反应中NO2 的物质的量变化较大,则X表示NO2的物质的量随时间的变化曲线,
故答案为:X;
(2)温度降低,正逆反应速率都减慢,
故答案为:减慢;减慢;
(3)分别测得甲中v(NO2)=0.3mol/(L•s),乙中v(N2O4)=6mol/(L•min),v(NO2)=2v(N2O4)=0.6mol•L-1•min-1=0.01mol/(L•s),则甲反应较快,
故答案为:甲;
(4)v(N2O4)=$\frac{0.7mol-0.4mol}{2L×3min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(5)A.v(NO2)=2v(N2O4),未体现正与逆的关系,故错误;
B.容器内压强不再发生变化,说明达平衡状态,故正确;
C.X的体积分数不再发生变化,说明达平衡状态,故正确;
D.容器内气体原子总数不再发生变化,从反应发生容器中原子总数就不变,所以不能作平衡状态的标志,故错误;
E. 只要反应发生就符合相同时间内消耗n mol的Y的同时生成2n mol的X,所以不一定达平衡状态,故错误;
F.相同时间内消耗n mol的Y的同时消耗2n mol的X,说明达平衡状态,故正确;
故选:BCF.
点评 本题考查较为综合,涉及化学反应与图象、化学反应速率的计算和大小比较、化学平衡状态的标志等,题目难度中等,注意把握化学反应速率以及化学平衡的基本知识即可解答该题.

| A. | CO燃烧 | B. | H2SO4与NaOH反应 | ||
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 | D. | 生石灰与水作用 |
| A. | 2,2-二甲基丙烷和新戊烷 | |
| B. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| C. | 对氯甲苯和邻氯乙苯 | |
| D. | 甲基丙烯酸和甲酸丁酯 |
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 升高温度正反应速率增大,则逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
