题目内容
18.下列说法正确的是( )| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第二周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
分析 A.第ⅢA、第ⅣA族某些元素的最外层电子数等于或大于3,但属于金属元素;
B.稀有气体He元素的最外层含有2个电子;
C.每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个;
D.如是阳离子,则位于第四周期,阴离子位于第三周期.
解答 解:A.第ⅢA的Al、Ga、In等最外层电子数为3,第ⅣA族的Ge、Sn等最外层电子数为4,属于金属元素,故A错误;
B.原子最外层只有2个电子的元素不一定是第ⅡA族元素,溶于He,故B错误;
C.每层容纳的电子为2n2个,无论哪层为最外层时,最外层电子不超过8个,显然外层电子数比次外层电子数多的元素一定位于第二周期,故C正确;
D.K+ ,最外层与次外层电子数相等,但K元素位于第四周期,故D错误;
,最外层与次外层电子数相等,但K元素位于第四周期,故D错误;
故选C.
点评 本题考查原子结构与元素在周期表中位置的关系,题目难度不大,注意把握元素周期表的结构以及原子核外电子排布特点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 升高温度正反应速率增大,则逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
6.关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是( )
| A. | 取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 | |
| B. | 取等体积的两种酸溶液分别稀释至原溶液的m倍和n倍,稀释后两溶液的pH仍然相同,则m<n | |
| C. | 取等体积的两种酸溶液分别与足量的锌粒反应,生成氢气的体积醋酸大于盐酸 | |
| D. | 取等体积的两种酸溶液分别与NaOH溶液中和,消耗NaOH的物质的量醋酸大于盐酸 |
13.钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域.工业上利用冶炼铝生成的固体废料--赤泥(主要成份为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:
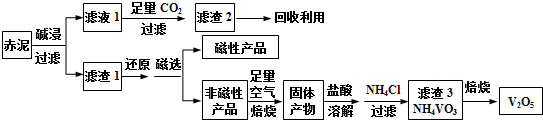
已知:钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O?VO3-+2H+.下列说法正确的是( )

已知:钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O?VO3-+2H+.下列说法正确的是( )
| A. | 工业生产中,碱浸步骤可选用较为廉价的氨水 | |
| B. | 可以推测VO2Cl溶解度大于NH4VO3 | |
| C. | 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸以使其溶解完全 | |
| D. | 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见血红色,则磁性产品中一定不含铁元素 |
3.四氯化碳是生产金属钛及其化合物的重要中间体,实验窒利用反应:TiO2(s)+2CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),制取TiCl4,实验装置如图所示: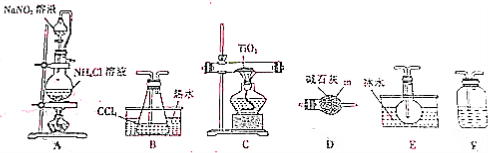
有关物质的性质如下表:
回答下列问题:
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中态混合采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序②③①
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请件数对其他装置的改变:石英管内改为盛TiO2和C.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中态混合采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序②③①
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请件数对其他装置的改变:石英管内改为盛TiO2和C.
8.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 一定量的Na与O2完全反应生成1mol产物时,转移电子数为2NA | |
| B. | 23g乙醇与足量金属钠完全反应时,可生成5.6L氢气 | |
| C. | 1molHCl气体与1molNH3完全反应时,可生成NA个NH4Cl分子 | |
| D. | 若1molCH4与1molCl2光照下充分反应,则生成的一氯甲烷分子的数目为NA |
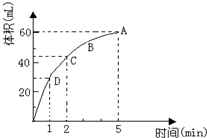 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示,5分钟时反应停止.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示,5分钟时反应停止.请依图回答下列问题: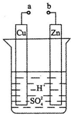 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置: