题目内容
13.下列方程式书写正确的是( )| A. | 乙醇与金属钠反应产生氢气:CH3CH2OH+Na→CH3CH2ONa+H2↑ | |
| B. | 苯与浓硫酸、浓硝酸的混合溶液共热制硝基苯: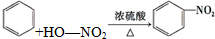 | |
| C. | 乙酸与乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2BrCH2Br |
分析 A.没有配平;
B.反应生成硝基苯和水;
C.发生酯化反应生成乙酸乙酯和水;
D.发生加成反应生成1,2-二溴乙烷.
解答 解:A.乙醇与金属钠反应产生氢气的反应为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,故A错误;
B.苯与浓硫酸、浓硝酸的混合溶液共热制硝基苯的反应为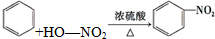 +H2O,故B错误;
+H2O,故B错误;
C.乙酸与乙醇发生反应生成乙酸乙酯的反应为CH3CH2OH+CH3COOH$→_{△}^{催化剂}$CH3COOCH2CH3+H2O,故C错误;
D.乙烯使溴的四氯化碳溶液褪色的化学反应为CH2=CH2+Br2→CH2BrCH2Br,故D正确;
故选D.
点评 本题考查有机化学反应方程式的书写,为高频考点,把握有机物官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列各组反应(表中物质均为反应物),反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | |||
| A | Mg | 0.1 | 6mol/L盐酸 | 10mL | 30℃ |
| B | Mg | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| C | Fe | 0.1 | 3mol/L盐酸 | 10mL | 60℃ |
| D | Mg | 0.1 | 6mol/L盐酸 | 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
4.下列各组物质属于同系物的是( )
| A. | 2,2-二甲基丙烷和新戊烷 | |
| B. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| C. | 对氯甲苯和邻氯乙苯 | |
| D. | 甲基丙烯酸和甲酸丁酯 |
8.下列说法正确的是( )
| A. | 化学反应速率可表示可逆反应进行的程度 | |
| B. | 升高温度正反应速率增大,则逆反应速率也增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
18.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
.
(2)③元素与⑩元素两者核电荷数之差是26.
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下列空格.
实验原理(化学方程式):Cl2+2NaBr=2NaCl+Br2
实验步骤:将少量氯水加入盛有溴化钠溶液的试管中,振荡后,加入少量四氯化碳,振荡
实验现象:若加入氯水后溶液呈黄色,加入少量四氯化碳后,四氯化碳层呈棕色;
结论:证明单质氯比单质溴氧化性强..
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)③元素与⑩元素两者核电荷数之差是26.
(3)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下列空格.
实验原理(化学方程式):Cl2+2NaBr=2NaCl+Br2
实验步骤:将少量氯水加入盛有溴化钠溶液的试管中,振荡后,加入少量四氯化碳,振荡
实验现象:若加入氯水后溶液呈黄色,加入少量四氯化碳后,四氯化碳层呈棕色;
结论:证明单质氯比单质溴氧化性强..
5.下表是元素周期表的一部分,针对表中元素,填写下列空白.
(1)写出Na+结构示意图 ,氯元素的原子结构示意图
,氯元素的原子结构示意图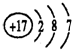 ;
;
(2)F、Cl、S的氢化物中稳定性最强的是HF(填氢化物名称);
(3)表中氧化性最强的单质的化学式为F2;
(4)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(5)氧和钠两种元素中,离子半径较小的是Na+(填离子符号);
(6)氧,硫,磷三种元素的气态氢化物的稳定性强弱顺序为H2O>H2S>PH3(填化学式);
(7)碳与氧形成的化合物中,固态时俗称干冰的电子式 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
 ,氯元素的原子结构示意图
,氯元素的原子结构示意图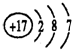 ;
;(2)F、Cl、S的氢化物中稳定性最强的是HF(填氢化物名称);
(3)表中氧化性最强的单质的化学式为F2;
(4)这些元素的最高价氧化物的水化物中,碱性最强的是NaOH(填化学式);
(5)氧和钠两种元素中,离子半径较小的是Na+(填离子符号);
(6)氧,硫,磷三种元素的气态氢化物的稳定性强弱顺序为H2O>H2S>PH3(填化学式);
(7)碳与氧形成的化合物中,固态时俗称干冰的电子式
 ,该化合物属于共价(填“共价”或“离子”)化合物.
,该化合物属于共价(填“共价”或“离子”)化合物.
2.最近媒体报道了一些化学物质,如爆炸力极强的N5,结构类似白磷的P4,比黄金还贵的18O2,太空中的甲醇气团等.下列说法正确的是( )
| A. | 2N5═5N2是化学变化 | B. | 18O2和16O2是同位素 | ||
| C. | 18O的原子内有9个中子 | D. | P4只有共价键 |
3.四氯化碳是生产金属钛及其化合物的重要中间体,实验窒利用反应:TiO2(s)+2CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),制取TiCl4,实验装置如图所示:
有关物质的性质如下表:
回答下列问题:
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中态混合采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序②③①
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请件数对其他装置的改变:石英管内改为盛TiO2和C.

有关物质的性质如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,加热时能被氧气氧化 |
(1)仪器m的名称为球形干燥管.
(2)装置A中有氮气生成,该反应的化学方程式为NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+NaCl+2H2O
(3)实验装置依次连接的顺序为A→F→B→C→E→D.装置F中盛有的物质是浓硫酸(4)装置D的作用是防止外界的水汽进入TiCl4收集装置里.
(5)欲分离装置E中态混合采用操作的名称是蒸馏.
(6)反应结束前进行如下操作:①停止通氮气②熄灭酒精灯③冷却至室温,正确的操作顺序②③①
(7)利用反应:TiO2(s)+2C(s)+2Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),也可以制取TiCl4,除了在上述实验装置中将装置A改为氯气的发生装置,撤去装置B之外,请件数对其他装置的改变:石英管内改为盛TiO2和C.
 .
.