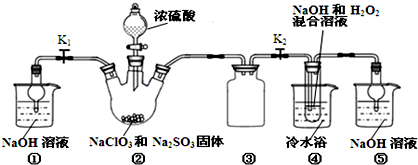
题目内容
氢氧化镁:①是中强碱;②广泛用作阻燃剂和填充剂.以白云石(化学式:MgCO3?CaCO3)为原料制备氢氧化镁的工艺流程如下:
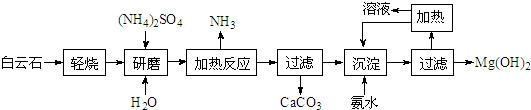
(1)根据流程图,白云石“轻烧”后固体产物的主要成份是MgO和 (写化学式).
(2)流程图中“加热反应”有氨气生成的化学方程式为 .
(3)洗涤Mg(OH)2沉淀所用玻璃仪器有: 、烧杯、玻棒;检验洗净的方法是 .
(4)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是 .
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10-4mol/L,Mg(O2)22-、Mg(OH)42-的浓度共为2.35×10-4mol/L,则溶液的pH= (取整数值);若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22-、Mg(OH)42-的浓度共为1.50×10-4mol/L,则该工艺的产率为 (保留4位小数).

(1)根据流程图,白云石“轻烧”后固体产物的主要成份是MgO和
(2)流程图中“加热反应”有氨气生成的化学方程式为
(3)洗涤Mg(OH)2沉淀所用玻璃仪器有:
(4)传统工艺是将白云石高温分解为氧化镁和氧化钙后提取,而该工艺采用轻烧白云石的方法,其优点是
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10-4mol/L,Mg(O2)22-、Mg(OH)42-的浓度共为2.35×10-4mol/L,则溶液的pH=
考点:制备实验方案的设计
专题:实验设计题,元素及其化合物
分析:流程分析白云石主要成分为MgCO3?CaCO3轻烧,从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体,
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O;
(3)洗涤氢氧化镁沉淀应在过滤器中进行,检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子;
(4)减少能源消耗、便于CaCO3分离;
(5)溶液中离子电荷守恒计算;产率=
×100%.
(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO
| ||
(3)洗涤氢氧化镁沉淀应在过滤器中进行,检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子;
(4)减少能源消耗、便于CaCO3分离;
(5)溶液中离子电荷守恒计算;产率=
| 实际量 |
| 理论量 |
解答:
解:(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁,分解生成氧化镁,白云石“轻烧”后固体产物的主要成份CaCO3、MgO;
故答案为:CaCO3;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O
故答案为:(NH4)2SO4+MgO
MgSO4+2NH3↑+H2O;
(3)洗涤氢氧化镁沉淀应在过滤器中进行,检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子,洗涤Mg(OH)2沉淀所用玻璃仪器有漏斗、烧杯、玻棒等,取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
故答案为:漏斗;取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
(4)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离;
故答案为:减少能源消耗或便于CaCO3分离;
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10-4mol/L,Mg(O2)22-、Mg(OH)42-的浓度共为2.35×10-4mol/L,溶液则电荷守恒得到,2c(Mg2+)=c(OH-)+2c[Mg(O2)22-]+2c[Mg(OH)42-],
C(OH-)=2×2.80×10-4mol/L-22.35×10-4mol/L=8.4×10-5,c(H+)≈10-10mol/L,则溶液的pH=10;
若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22-、Mg(OH)42-的浓度共为1.50×10-4mol/L,则该工艺的产率=
×100%=99.97%,
故答案为:10;99.97%.
故答案为:CaCO3;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO
| ||
故答案为:(NH4)2SO4+MgO
| ||
(3)洗涤氢氧化镁沉淀应在过滤器中进行,检验洗涤干净的方法是取最后一次洗涤液检验是否含有硫酸根离子,洗涤Mg(OH)2沉淀所用玻璃仪器有漏斗、烧杯、玻棒等,取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
故答案为:漏斗;取洗涤液加入氯化钡溶液,若无沉淀生成,说明已洗净;
(4)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离;
故答案为:减少能源消耗或便于CaCO3分离;
(5)25℃时Mg(OH)2饱和溶液的中:c(Mg2+)=2.80×10-4mol/L,Mg(O2)22-、Mg(OH)42-的浓度共为2.35×10-4mol/L,溶液则电荷守恒得到,2c(Mg2+)=c(OH-)+2c[Mg(O2)22-]+2c[Mg(OH)42-],
C(OH-)=2×2.80×10-4mol/L-22.35×10-4mol/L=8.4×10-5,c(H+)≈10-10mol/L,则溶液的pH=10;
若经过循环利用,每制得5.8t Mg(OH)2时排出200m3的废水,其中Mg2+、Mg(O2)22-、Mg(OH)42-的浓度共为1.50×10-4mol/L,则该工艺的产率=
| 5.8×106 |
| 5.8×106+1.5×10-4×200×103×58g/mol |
故答案为:10;99.97%.
点评:本题考查了物质分离方法和流程理解应用,主要是混合物分离试剂的作用,产物的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学用语描述中正确的是( )
A、含18个中子的氯原子的核素符号:
| ||
B、比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | ||
| C、HCO3-的电离方程式为:HCO3-+H2O?CO32-+H3O+ | ||
| D、次氯酸的结构式:H-Cl-O |
常温时,0.01mol?L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
| A、上述弱酸溶液的pH≈4 |
| B、加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大 |
| C、加水稀释后,溶液中所有分子、离子浓度都减小 |
| D、加入等体积0.01 mol?L-1 NaOH溶液后,所得溶液的pH<7 |
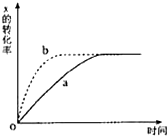 如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进
如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
| A、升高温度 |
| B、加大N的投入量 |
| C、缩小体积 |
| D、加大X的投入量 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某元素,它们之间具有如下转化关系:甲
乙
丙.下列有关物质的推断不正确的是( )
| 丁 |
| 丁 |
| 甲 |
| A、若甲为C2H5OH,则丙可能为CH3COOH |
| B、若涉及反应均为氧化还原反应,则甲可能为Cl2 |
| C、若涉及反应均为氧化还原反应,则丁可能为O2 |
| D、若甲为AlCl3溶液,则丁可能是NaOH溶液 |