题目内容
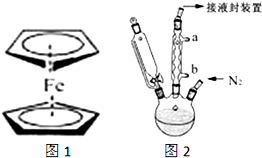 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O二茂铁的熔点为172~173℃,在100℃开始升华.能溶于乙醚、二甲亚砜等非极性溶剂,不溶于水,对碱和非氧化性酸稳定.制备的步骤如下:
步骤1.在150mL的三颈瓶中加入25g细粉末状KOH和60mL无水乙醚,通入氮气并搅拌约10分钟使之尽可能溶解,然后加入5.5mL环戊二烯,再搅拌10钟.
步骤2.无水氯化亚铁的制备.
后向烧杯中加入25mL二甲亚砜和6.5g新制的无水氯化亚铁,微热至40℃并搅拌使其溶解,然后加入滴液漏斗中.
步骤3.按如图2所示的装置装配好仪器,打开滴液漏斗的活塞,缓慢将氯化亚铁等加入三颈瓶中,并继续搅拌1小时.
步骤4.反应结束后,将混合物倒入100mL 18%的盐酸溶液,将烧杯放在冰浴中冷却,搅拌约10分钟,使结晶完全.
步骤5.抽滤,将获得的产品以冷水洗涤2~3次,低温风干得到粗制的二茂铁.
(1)步骤1中通入N2的目的可能是
(2)步骤2中,滴液漏斗侧边的玻璃导管的作用是
(3)实验装置中,冷凝管通水,水应从
(4)步骤2无水氯化亚铁制备的具体操作是先将铁粉溶于
(5)步骤4将反应后的混合物倒入盐酸中,发生主要反应的离子方程式是
(6)步骤5用冷水洗涤是因为
(7)用测得相对分子质量的方法,可以检验所得产物是否纯净,测得相对分子质量通常采用的仪器是
考点:制备实验方案的设计
专题:实验题,有机物的化学性质及推断
分析:(1)二茂铁中铁是+2价,易被氧化;
(2)滴液漏斗侧边的玻璃导管均衡漏斗内压强,便于液体放出;
(3)为了使冷凝效果好,水应从下进上出;
(4)在用铁和盐酸反应制备氯化亚铁过程中要防止亚铁离子水解和被氧化,据此答题;
(5)二茂铁是在碱性条件下制得的,反应混合物倒入盐酸中后发生中和反应;
(6)二茂铁100℃开始升华,所以洗涤时要用冷水,提纯也可用升华这个性质;
(7)测得相对分子质量通常采用的仪器是质谱仪.
(2)滴液漏斗侧边的玻璃导管均衡漏斗内压强,便于液体放出;
(3)为了使冷凝效果好,水应从下进上出;
(4)在用铁和盐酸反应制备氯化亚铁过程中要防止亚铁离子水解和被氧化,据此答题;
(5)二茂铁是在碱性条件下制得的,反应混合物倒入盐酸中后发生中和反应;
(6)二茂铁100℃开始升华,所以洗涤时要用冷水,提纯也可用升华这个性质;
(7)测得相对分子质量通常采用的仪器是质谱仪.
解答:
解:(1)二茂铁中铁是+2价,易被氧化,所以要用氮气排出容器中的空气,
故答案为:排出三颈瓶内的空气;
(2)滴液漏斗侧边的玻璃导管均衡漏斗内压强,便于液体放出,
故答案为:均衡漏斗内压强,便于液体放出;
(3)为了使冷凝效果好,水应从下进上出,所以在图中冷水应从b处进,
故答案为:b;
(4)在用铁和盐酸反应制备氯化亚铁过程中要防止亚铁离子水解和被氧化,所以要先将铁粉溶于浓盐酸中,再加蒸馏水稀释,过滤,加入几颗铁钉,目的是防止Fe2+被氧化,蒸发浓缩、冷却结晶,过滤,在干燥HCl气流中加热脱水,获得无水氯化亚铁,
故答案为:浓盐酸;蒸馏水稀释;防止Fe2+被氧化;在干燥HCl气流中加热;
(5)二茂铁是在碱性条件下制得的,反应混合物倒入盐酸中后发生中和反应,离子反应方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
(6)因为二茂铁100℃开始升华,所以洗涤时要用冷水,提纯也可用升华这个性质,所以得到粗制的二茂铁后可采用加热升华的方法,进一步提纯二茂铁,
故答案为:二茂铁易于升华;加热升华;
(7)测得相对分子质量通常采用的仪器是质谱仪,故答案为:质谱仪.
故答案为:排出三颈瓶内的空气;
(2)滴液漏斗侧边的玻璃导管均衡漏斗内压强,便于液体放出,
故答案为:均衡漏斗内压强,便于液体放出;
(3)为了使冷凝效果好,水应从下进上出,所以在图中冷水应从b处进,
故答案为:b;
(4)在用铁和盐酸反应制备氯化亚铁过程中要防止亚铁离子水解和被氧化,所以要先将铁粉溶于浓盐酸中,再加蒸馏水稀释,过滤,加入几颗铁钉,目的是防止Fe2+被氧化,蒸发浓缩、冷却结晶,过滤,在干燥HCl气流中加热脱水,获得无水氯化亚铁,
故答案为:浓盐酸;蒸馏水稀释;防止Fe2+被氧化;在干燥HCl气流中加热;
(5)二茂铁是在碱性条件下制得的,反应混合物倒入盐酸中后发生中和反应,离子反应方程式为H++OH-=H2O,
故答案为:H++OH-=H2O;
(6)因为二茂铁100℃开始升华,所以洗涤时要用冷水,提纯也可用升华这个性质,所以得到粗制的二茂铁后可采用加热升华的方法,进一步提纯二茂铁,
故答案为:二茂铁易于升华;加热升华;
(7)测得相对分子质量通常采用的仪器是质谱仪,故答案为:质谱仪.
点评:本题主要考查了二茂铁的制备,涉及有机、无机、化学实验等知识点,综合性较强,中等难度,解题时要注意亚铁离子易被氧化和水解这两个特点.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
在三个密闭容器中分别充入Ar、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
| A、p(H2)>p(O2)>p(Ar) |
| B、p(O2)>p(Ar )>p(H2) |
| C、p(Ar)>p(H2)>p(O2) |
| D、p(H2)>p(Ar)>p(O2) |
下列说法正确的是( )
| A、1molO2和1molN2所占的体积都约为22.4L | ||
B、30% 氨水物质的量浓度为c,稀释至15%后,物质的量浓度比
| ||
| C、等质量的NO2和N2O4所含原子数一定相等 | ||
| D、等体积、等物质的量浓度的强酸溶液中所含的H+离子数一定相等 |
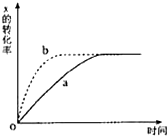 如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进
如图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
| A、升高温度 |
| B、加大N的投入量 |
| C、缩小体积 |
| D、加大X的投入量 |
下列离子方程式中正确的是( )
| A、碳酸氢钙溶液中加入过量氢氧化钠Ca2-+2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe2++3H2O |
| C、AlCl3溶液中加入过量的浓氨水:Al3++4NH3?H2O═AlO2-+2NH4++2H2O |
| D、Na2S溶液呈碱性:S2-+H2O=HS-+OH- |