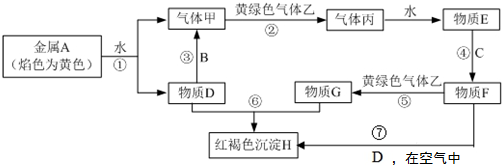
题目内容
15.对于反应2NO2(g)?N2O4(g)△H<0,达到平衡后缩小容器体积,下列说法正确的是( )| A. | 平衡逆向移动 | B. | 混合气体颜色比原来深 | ||
| C. | 混合气体颜色比原来浅 | D. | 混合气体的平均相对分子质量变小 |
分析 对于反应2NO2(g)?N2O4(g)△H<0,达到平衡后缩小容器体积,增大了压强,平衡向着正向移动,混合气体的总物质的量减小,则混合气体的平均摩尔质量增大;由于缩小容器体积后二氧化氮浓度增大,则混合气体的颜色比原来变深.
解答 解:反应2NO2(g)?N2O4(g)△H<0,反应是气体体积减小的放热反应,达到平衡后缩小容器体积,增大了压强,平衡正向移动,
A.压强增大,该平衡向着正向进行,故A错误;
B.增大压强,体积迅速减小,平衡移动程度不如体积减小带来的改变大,所以混合气体颜色加深,故B正确;
C.增大压强,体积迅速减小,平衡移动程度不如体积减小带来的改变大,所以混合气体颜色加深,故C错误;
D.增大压强,气体质量不变,物质的量减小,混合气体的平均相对分子质量变大,故D错误;
故选B.
点评 本题考查了化学平衡及其影响,题目难度中等,明确影响化学平衡的元素为解答关键,注意增大压强后平衡向着正向移动,但是二氧化氮浓度会增大,为易错点.

练习册系列答案
相关题目
6.下列物质中,能够导电的电解质是( )
| A. | 液态HCl | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | 蔗糖 |
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8g Na2O2中离子总数为0.4NA | |
| B. | 标准状况下,11.2L CCl4的分子数为0.5NA | |
| C. | 常温常压下,48 g O2和O3的混合气体中含有的氧原子数为3NA | |
| D. | 1mol•L-1MgCl2溶液中含有氯离子个数为2NA |
10.将足量的CO2通入下列溶液中,能产生沉淀的是( )
| A. | 硅酸钠溶液 | B. | 石灰水 | C. | 次氯酸钠溶液 | D. | 氯化钙溶液 |
4.下列溶液中离子一定能大量共存的是( )
| A. | 0.1mol/LNaOH溶液中:Na+、K+、Ca2+、HCO3- | |
| B. | 无色溶液中:H+、Fe2+、Al3+、NO3- | |
| C. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| D. | pH>7的溶液中:Na+、K+、AlO2-、SO42- |
5.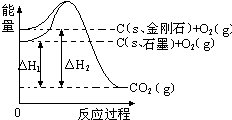 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )| A. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 石墨和金刚石是同分异构体 |