题目内容
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 7.8g Na2O2中离子总数为0.4NA | |
| B. | 标准状况下,11.2L CCl4的分子数为0.5NA | |
| C. | 常温常压下,48 g O2和O3的混合气体中含有的氧原子数为3NA | |
| D. | 1mol•L-1MgCl2溶液中含有氯离子个数为2NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠中含2个钠离子和1个阴离子来分析;
B、标况下四氯化碳为液体;
C、氧气和臭氧均由氧原子构成;
D、溶液体积不明确.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠中含2个钠离子和1个阴离子,故0.1mol过氧化钠中含0.2mol钠离子和0.1mol阴离子,共0.3mol离子即0.3NA个,故A错误;
B、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、氧气和臭氧均由氧原子构成,故48g混合物中含有的物质的量为n=$\frac{48g}{16g/mol}$=3mol,个数为3NA个,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
13. 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
表中①、②处的数据分别是25、7.0.
III.讨论与交流
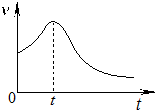
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.实验仪器
I.实验原理:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O.
Ⅱ.实验设计
(1)【方案】观察反应现象:在其它相同条件下,测定不同浓度H2C2O4溶液与等体积等浓度KMnO4
溶液混合后,溶液褪色所需的时间.拟定实验数据:
| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
III.讨论与交流
(2)小组同学在处理一系列的实验数据时,发现速率(v)-时间(t)曲线如图所示.他们认为:0~t时间内,速率变快的可能原因是①产物Mn2+是反应的催化剂、②该反应放热使温度升高.
(3)实验室常用KMnO4标准溶液滴定某浓度草酸.
KMnO4溶液置于酸式滴定管(填仪器名称)中,判断到达滴定终点的现象是溶液由无色变为浅紫红色,且半分钟内不褪色.若读取滴定管数据时,起始读数正确,终点俯视读数,则测定结果偏低(填“偏高”、“偏低”、“无影响”).
11.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)?C(g)+D(g)已达到平衡状态( )
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体的总物质的量
⑤混合气体的平均相对分子质量
⑥v(C)与v(D)的比值
⑦混合气体的总质量.
| A. | ②③④⑤⑥⑦ | B. | ①③④⑤ | C. | ①②③④⑤⑦ | D. | ①③⑤ |
18.有A、B、C、D四种物质,已知它们能发生如下反应:
①A2++B═B2++A ②A2++C═C2++A
③B2++C═C2++B ④C2++D═D2++C( )
①A2++B═B2++A ②A2++C═C2++A
③B2++C═C2++B ④C2++D═D2++C( )
| A. | 氧化性:A2+>B2+>C2+>D2+ | B. | 氧化性:D2+>C2+>B2+>A2+ | ||
| C. | 还原性:A>B>C>D | D. | 还原性:C>D>B>A |
8.下列实验操作或处理正确的是( )
| A. | 将NaOH溶液逐滴加入饱和的FeCl3溶液中制取Fe(OH)3胶体 | |
| B. | 氯气泄漏后应顺风向低处跑 | |
| C. | 金属钠着火立刻用湿布盖灭 | |
| D. | 做完焰色反应实验的铂丝用稀盐酸清洗 |
15.对于反应2NO2(g)?N2O4(g)△H<0,达到平衡后缩小容器体积,下列说法正确的是( )
| A. | 平衡逆向移动 | B. | 混合气体颜色比原来深 | ||
| C. | 混合气体颜色比原来浅 | D. | 混合气体的平均相对分子质量变小 |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 71g氯气中氯原子数为NA | |
| B. | 标准状况下,22.4LNH3所含的电子数为10NA | |
| C. | 5.6gFe在足量氯气中燃烧转移的电子数为2NA | |
| D. | 标准状况下,11.2L H2O中含有分子的数目为0.5NA |
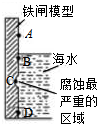 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,