题目内容
5.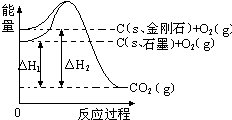 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )| A. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 石墨和金刚石是同分异构体 |
分析 先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量,石墨和金刚石是由同一种元素组成的不同单质,互为同素异形体来解答.
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的能量越高越不稳定,则石墨比金刚石稳定,故C错误;
D、石墨和金刚石是由同一种元素组成的不同单质,互为同素异形体,故D错误;
故选A.
点评 本题考查热利用盖斯定律书写热化学方程式、物质的能量越低越稳定,题目难度不大,注意物质的稳定性与能量的关系.

练习册系列答案
相关题目
15.对于反应2NO2(g)?N2O4(g)△H<0,达到平衡后缩小容器体积,下列说法正确的是( )
| A. | 平衡逆向移动 | B. | 混合气体颜色比原来深 | ||
| C. | 混合气体颜色比原来浅 | D. | 混合气体的平均相对分子质量变小 |
16.下列离子方程式,只能表示一个化学反应的是( )
①CO32-+2H+═CO2↑+H2O
②OH-+H+═H2O
③Ag++Cl-═AgCl↓
④Fe+Cu2+═Fe2++Cu
⑤Cl2+H2O═H++Cl-+HClO.
①CO32-+2H+═CO2↑+H2O
②OH-+H+═H2O
③Ag++Cl-═AgCl↓
④Fe+Cu2+═Fe2++Cu
⑤Cl2+H2O═H++Cl-+HClO.
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | 只有⑤ |
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 71g氯气中氯原子数为NA | |
| B. | 标准状况下,22.4LNH3所含的电子数为10NA | |
| C. | 5.6gFe在足量氯气中燃烧转移的电子数为2NA | |
| D. | 标准状况下,11.2L H2O中含有分子的数目为0.5NA |
20.下列说法错误的是( )
| A. | 室温下,pH=4的NaHSO4溶液中,水电离出的c(H+)为1×10-10mol•L-1 | |
| B. | 向纯水中加入盐类物质,有可能促进水的电离,也有可能抑制水的电离 | |
| C. | pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH${\;}_{4}^{+}$):②<③<① | |
| D. | 用0.1mol•L-1醋酸滴定0.1mol•L-1NaOH溶液至中性时:c(CH3COO-)+c(CH3COOH)>c(Na+) |
10.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 清晨的雾 | B. | 盐水 | C. | 蔗糖溶液 | D. | 浑浊泥水 |
14.将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2.m>n,则充分反应后,试管中气体在同温同压下的体积为( )
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3}$mL | C. | $\frac{4m-n}{3}$mL | D. | $\frac{3}{m-n}$mL |


 .
.