题目内容
8. 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | n>p | |
| C. | x点表示该反应的正反应速率小于逆反应速率 | |
| D. | x点比y点时的反应速率慢 |
分析 由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,由于A为固体则有n<p,在曲线上的点为平衡状态,以此来解答该题.
解答 解:A.由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,由于A为固体,所以m+n与p的关系不确定,故A错误;
B.由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,故B错误;
C.x点位于曲线上方,未达到平衡状态,由图象可以看出,当B的含量减小时,可趋向于平衡,则应是向正反应方向移动,即v正>v逆,故C错误;
D.由图象可以看出x点的压强小于y点压强,压强越大,反应速率越大,故x点比y点混合物的反应速率慢,故D正确.
故选D.
点评 本题考查化学平衡曲线问题,为高频考点,侧重于学生的分析能量的考查,题目难度不大,本题注意分析纵坐标随横坐标变化的趋势,特别是曲线的上的点与曲线外的点的区别.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
1.下列属于弱电解质的是( )
| A. | 甲烷 | B. | 亚硫酸 | C. | 碳酸钡 | D. | 氨水 |
19.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,一段时间后达平衡,反应过程中测定的部分数据见表:
下列说法不正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前5min的平均速率为v (SO2)=0.08mol•L-1•min-1 | |
| B. | 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% | |
| C. | 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆) | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
16.在一定条件下,向5L密闭容器中充入2molA气体和1mol B气体,发生可逆反应:2A(g)+B(g)?2C(g),达到平衡时容器内B的浓度为0.1mol/L,则此时B的转化率为( )
| A. | 10% | B. | 25% | C. | 50% | D. | 67% |
3.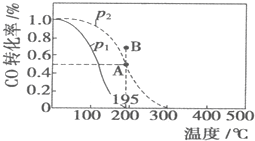 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
下列说法正确的是( )
 在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示
在20L恒容密闭容器中,按物质的量之比为1:2充入CO和H2发生:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol.测得CO的转化率随温度及不同压强的变化如图所示:n(H2)在P2及195℃时随时间变化如表所示| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
| A. | P1>P2,a<0 | |
| B. | 在P2及195℃时,反应前3min的平均速率v(CH3OH)=0.08mol/(L•min) | |
| C. | 在P2及195℃时,该反应的平衡常数为25(mol/L)-2 | |
| D. | 在B点时,v正>v逆 |
13.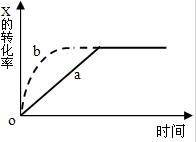 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
20. 某化学小组以环己醇
某化学小组以环己醇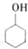 制备环己烯:已知
制备环己烯:已知
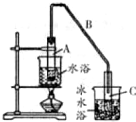
(1)制备粗品将12.5mL环已醇加入试管A中,再加入 1ml,浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环已烯粗品.
①写出环已醇制备环已烯的化学反应方程式
②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
 某化学小组以环己醇
某化学小组以环己醇 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
①写出环已醇制备环已烯的化学反应方程式

②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
17.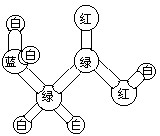 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醇 |
18.下列实验对应的现象及结论均正确且两者具有因果关系的选项是( )
| 选项 | 实验 | 现象 | 结论 |
| A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
| B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| C | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液 | 有白色沉淀生成 | 证明非金属性S>C>Si |
| D | 向含有淀粉的FeI2溶液中滴加足量的氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |