题目内容
13.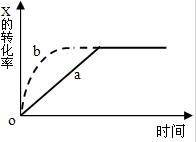 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
分析 由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,以此解答该题.
解答 解:由图象可知,由曲线a到曲线b,到达平衡的时间缩短,改变条件,反应速率加快,且平衡时x的转化率不变,说明条件改变不影响平衡状态的移动,
A.该反应正反应是放热反应,升高温度,反应速率加快,平衡向逆反应移动,x的转化率降低,故A错误;
B.加大X的投入量,X浓度增大,反应速率加快,平衡向正反应移动,但x的转化率降低,故B错误;
C.加入催化剂,反应速率加快,催化剂不影响平衡移动,x的转化率不变,故C正确;
D.N为固体,缩小体积,平衡正向移动,X的转化率增大,故D错误.
故选C.
点评 本题考查化学平衡移动图象与影响因素,为高频考点,侧重于学生的分析能量的考查,难度中等,根据曲线变化分析条件改变对速率、X转化率的影响是解题的关键,注意对平衡移动原理的理解.

练习册系列答案
相关题目
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,1LpH=2的HCl溶液中,由水电离出的H+的数目0.01NA | |
| B. | 标准状况下,2.24L的CCl4中含有的氯原子数为0.4NA | |
| C. | 常温下,1molCO2中含有的共用电子对数目为2NA | |
| D. | 标准状况下,2.24L Cl2与水充分反应,转移的电子数小于0.1NA |
4.磷矿石主要以[Ca3(PO4)2•H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:

部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是CaSiO3(填化学式),冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是CaSiO3(填化学式),冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
1.三苯甲醇是一种重要的化工原料和医药中间体,实验室合成三苯甲醇[(C6H5)3COH]的合成流程如图1所示.
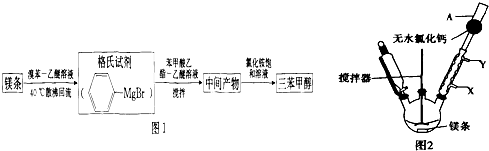
已知:Ⅰ)格氏试剂容易水解:
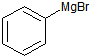 +H2O→
+H2O→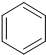 +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)
Ⅱ)相关物质的物理性质如下:
Ⅲ)三苯甲醇的相对分子质量是260,纯净固体有机物一般都有固定熔点.
请回答以下问题:
(1)实验室合成三苯甲醇的装置如图2,写出玻璃仪器A的名称干燥管,装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是受热均匀,便于控制温度,微沸回流时冷凝管中水流的方向是X→Y(填“X→Y”或“Y→X”).
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁、氯化铵等杂质,可以设计如下提纯方案,请填写空白:
粗产品$\stackrel{操作①}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$ 三苯甲醇
其中,操作①为:蒸馏;洗涤液最好选用:A.
A.水B.乙醚C.乙醇D.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80mL(标准状况).产品中三苯甲醇质量分数为(保留两位有效数字).若配成乙醇溶液,来测三苯甲醇质量分数90%,结果会偏高(填“偏高”、“不变”或“偏低”).

已知:Ⅰ)格氏试剂容易水解:
 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
请回答以下问题:
(1)实验室合成三苯甲醇的装置如图2,写出玻璃仪器A的名称干燥管,装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是受热均匀,便于控制温度,微沸回流时冷凝管中水流的方向是X→Y(填“X→Y”或“Y→X”).
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁、氯化铵等杂质,可以设计如下提纯方案,请填写空白:
粗产品$\stackrel{操作①}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$ 三苯甲醇
其中,操作①为:蒸馏;洗涤液最好选用:A.
A.水B.乙醚C.乙醇D.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80mL(标准状况).产品中三苯甲醇质量分数为(保留两位有效数字).若配成乙醇溶液,来测三苯甲醇质量分数90%,结果会偏高(填“偏高”、“不变”或“偏低”).
8.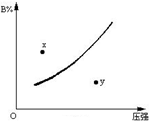 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | n>p | |
| C. | x点表示该反应的正反应速率小于逆反应速率 | |
| D. | x点比y点时的反应速率慢 |
2.下列溶液中Cl-浓度最大的是( )
| A. | 1000mL 2.5mol/L NaCl 溶液 | B. | 300mL 5mol/L KClO3溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 200mL 2mol/L MgCl2 溶液 |
 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验: 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: