题目内容
19.一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,一段时间后达平衡,反应过程中测定的部分数据见表:| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前5min的平均速率为v (SO2)=0.08mol•L-1•min-1 | |
| B. | 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% | |
| C. | 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆) | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
分析 A.根据化学反应速率v=$\frac{△c}{△t}$来计算;
B.可计算平衡常数,根据平衡常数计算;
C.温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,相当于增大压强,根据压强对化学平衡的影响来回答判断;
D.根据B的计算,判断平衡时转化的程度,可计算吸收的热量.
解答 解:A.反应在前5min的平均速率为v (SO2)=$\frac{△c}{△t}$=$\frac{\frac{2-1.2}{2}}{5}$mol/(L•min)=0.08mol•L-1 min-1,故A正确;
B.2SO2(g)+O2(g)?2SO3(g)
初始量:2 1 0
变化量:1.2 0.6 1.2
平衡量:0.8 0.4 1.2
化学平衡常数K=$\frac{(\frac{1.2}{2})^{2}}{(\frac{0.8}{2})^{2}×\frac{0.4}{2}}$=$\frac{45}{4}$
起始时向容器中充入1.5mol SO3,如果转化率是40%,则
2SO2(g)+O2(g)?2SO3(g)
初始量:0 0 0.75
变化量:0.3 0.15 0.3
平衡量:0.3 0.15 0.45
此时K=$\frac{0.4{5}^{2}}{0.{3}^{2}×0.15}$≠$\frac{45}{4}$,故B错误;
C.温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,此时$\frac{0.6{5}^{2}}{0.{5}^{2}×0.15}$>$\frac{45}{4}$,化学平衡正向移动,v(正)>v(逆),故C正确;
D.通过计算,当反应进行到10min时,二氧化硫的物质的量是0.8mol,所以10min就达到化学平衡状态,此时反应放出的热量是0.4×196kJ=78.4kJ,起始时向容器中充入2molSO3,达到的平衡和充入2molSO2以及1molO2建立的平衡是等效的,互为逆反应的过程是吸热的,所以达平衡时吸收78.4kJ的热量,故D正确.
故选B.
点评 本题综合考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及等效平衡的建立以及化学反应达到平衡时物质的转化率等方面的知识,属于综合知识的考查,难度较大.

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | HCl | B. | NH4Cl | C. | NaHSO4 | D. | H2SO4 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为18 | |
| B. | 容器②中达到平衡时放出的热量为0.05Q kJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率增大 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3 |
| A. | x=1 | |
| B. | 平衡时A的浓度为1.5 mol/L | |
| C. | B的转化率为20% | |
| D. | 反应起始和达到平衡时,混合气体的压强比为4:5 |

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是CaSiO3(填化学式),冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.
 反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(固)+nB(气)?pC(气)△H<0在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | m+n>P | |
| B. | n>p | |
| C. | x点表示该反应的正反应速率小于逆反应速率 | |
| D. | x点比y点时的反应速率慢 |
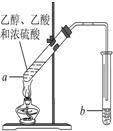 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.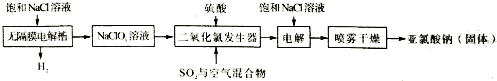
 .
.