题目内容
 牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:
牙有的成分有活性物质、摩擦剂、保持牙有湿润的甘油等物质.牙宵中的摩擦剂一般由CaCO3,、Al(OH)3,SiO2中的一种或儿种物质组成.为探究某品牌牙有中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适爱牙宵样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现仍有少铽不溶物.为进一步探究牙有中燴擦剂成分,同学们进行了以下探究:【提出假设】根据题目信息同学们提出了如下假设:
假设1:牙斉鹰擦剂的成分为SiO2和CaCO3
假设2:牙宵摩擦剂的成分为SiO2和Al(OH)3
假设 3:
【实验验证】设计实验方案,验证假设.请写出实验步骧以及预期现象和结论.(可不填满也可补充).可选的试剂:稀盐酸、稀硫酸、NaOH溶液、澄淸石灰水
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | |
| 步骤2: | |
| 步骤3: | |
| … |
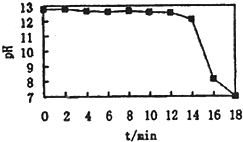
办组同学了解到一些品牌牙裔中的摩擦剂使用了纳米级碳酸钙.查阅资料知工业上常将电石渣进行处理,得到Ca(OH)2悬浊液,畀不断通入CO2,即可制得纳米级的CaCO3.通过传感器测得反应过程中溶液pH与反应时间的关系如图.
试回答:①反应一段时间内,PH变化很小的原因是
②临近反应终点时,溶液的PH急剧下降的原因是
考点:性质实验方案的设计
专题:实验设计题
分析:【提出假设】牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2,根据由上边物质中的两种组成,进行两种物质的组合考虑;根据预期实验结论猜想1正确,用猜想1的成分与盐酸反应考虑实验现象;根据若摩擦剂部分溶解,不产生气泡,说明不存在碳酸钙考虑哪一猜想正确;
【实验验证】碳酸钙可以和盐酸之间反应产生二氧化碳气体,氯化铝中逐滴加入氢氧化钠,会出现的现象:先生成白色胶状沉淀,后沉淀逐渐溶解,据此来检验即可;
【交流提高】根据随着过程的原理:反应中Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,临近反应终点时氢氧化钙大部分转化为CaCO3,溶液中OH-浓度下降,据此来回答.
【实验验证】碳酸钙可以和盐酸之间反应产生二氧化碳气体,氯化铝中逐滴加入氢氧化钠,会出现的现象:先生成白色胶状沉淀,后沉淀逐渐溶解,据此来检验即可;
【交流提高】根据随着过程的原理:反应中Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,临近反应终点时氢氧化钙大部分转化为CaCO3,溶液中OH-浓度下降,据此来回答.
解答:
解:【提出假设】牙膏摩擦剂的主要成分有CaCO3、Al(OH)3、SiO2,根据由上边物质中的两种组成,假设二:摩擦剂的成分为Al(OH)3和SiO2,所以还缺少SiO2和CaCO3的组合;所以假设三是SiO2和CaCO3,故答案为:SiO2和CaCO3;
【实验验证】成分物质中,碳酸钙可以和盐酸之间反应产生二氧化碳气体,若无气泡产生,说明无CaCO3,氢氧化铝可以和盐酸反应生成氯化铝,氯化铝中逐滴加入氢氧化钠,会出现的现象:先生成白色胶状沉淀,后沉淀逐渐溶解,故答案为:
【交流提高】
①Ca(OH)2悬浊液中不断通入CO2,随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,pH变化很小;
②临近反应终点时,Ca(OH)2大部分转化为CaCO3,溶液中OH-浓度下降
故答案为:随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,故pH变化很小;临近反应终点时,Ca(OH)2大部分转化为CaCO3,溶液中OH-浓度下降而CO2仍在不断通入,故pH急剧下降.
【实验验证】成分物质中,碳酸钙可以和盐酸之间反应产生二氧化碳气体,若无气泡产生,说明无CaCO3,氢氧化铝可以和盐酸反应生成氯化铝,氯化铝中逐滴加入氢氧化钠,会出现的现象:先生成白色胶状沉淀,后沉淀逐渐溶解,故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2:取适量沉淀于试管中,滴加过量稀盐酸 | 若出现无色气泡,则说明含有CaCO3,若无气泡,则说明无CaCO3,而有Al(OH)3. |
| 步骤3:取步骤2的上层清液,滴加氢氧化钠溶液 | 若先生成沉淀,后沉淀溶解说明含有Al(OH)3 若无明显现象,则无Al(OH)3 |
①Ca(OH)2悬浊液中不断通入CO2,随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,pH变化很小;
②临近反应终点时,Ca(OH)2大部分转化为CaCO3,溶液中OH-浓度下降
故答案为:随着反应的进行,溶液中的Ca(OH)2逐渐被消耗,而消耗的这部分又被溶解的Ca(OH)2所补充,整个溶液中的Ca(OH)2浓度无明显变化,故pH变化很小;临近反应终点时,Ca(OH)2大部分转化为CaCO3,溶液中OH-浓度下降而CO2仍在不断通入,故pH急剧下降.
点评:本题解答本题关键是要知道氢氧化铝与碳酸钙都不溶于水,但能与盐酸反应,并且碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,要根据实验结论能反推出实验现象,根据实验现象推出物质组成,得出实验结论,题目难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质一定不属于配合物的是( )
| A、K3Fe(CN)6 |
| B、Ag(NH3)2N03 |
| C、Al(NH4)(SO4)2 |
| D、Zn(NH4)4SO4 |
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

| A、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| B、若A为浓硫酸,B为木炭,C中盛有硅酸钠溶液,则C中出现白色浑浊 |
| C、若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色 |
| D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀不溶解 |
现有A和B的液态混合物,已知A和B的一些性质如下所示:根据图中的数据,分离A和B的液态混合物的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 在水中的溶解性 |
| A | -97℃ | 86.8℃ | 0.91g/cm3 | 可溶 |
| B | -95℃ | 54.6℃ | 0.89g/cm3 | 可溶 |
| A、过滤法 | B、蒸馏法 |
| C、萃取法 | D、分液法 |
常温下,在20mL0.1mol?L-1Na2CO3溶液中逐渐滴入0.1mol?L-1HCl溶液40mL,溶液的PH逐渐降低,下列说法正确的是( )
| A、完全反应以后,溶液呈现中性 |
| B、当盐酸加入10mL时,溶液中:c(CO32-)=C(HCO3-) |
| C、在20mL0.1mol?L-1Na2CO3溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-) |
| D、当盐酸加入20mL时,溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |









