题目内容
11.在25℃、1.01×105Pa条件下,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol-1能够自发进行.从能量上分析,生成物的总能量比反应物的总能量高,从反应前后的熵值看,反应后的熵值增加 (填“增加”、“减小”或“不变”).分析 该反应的焓变大于0,为吸热反应,反应物总能量大于生成物;△H-T△S<0的反应能够自发进行,该反应为气体体积增大的反应,其熵变大于0,据此进行解答.
解答 解:反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.7kJ•mol-1的△H>0,说明该反应为吸热反应,则生成物的总能量比反应物的总能量高;
该反应为气体体积增大的反应,则反应后物质的混乱度增加,其熵变△S>0,即熵值增加,
故答案为:高;增加.
点评 本题考查了反应热与焓变的关系及应用,题目难度不大,明确反应自发进行的条件为解答关键,注意掌握熵变的含义及判断方法,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
2.一定温度下,可逆反应A2(s)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时消耗3mol B2 | |
| C. | 容器内每减少1mol A2,同时消耗1mol B2 | |
| D. | 容器内每减少1mol A2,同时生成3mol B2 |
19.下列反应能用H++OH-=H2O表示的是( )
| A. | 氢氧化铜和稀盐酸 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清的石灰水和稀硝酸反应 | D. | 醋酸和氢氧化钠反应 |
6.太空探索器常用${\;}_{94}^{238}$Pu制成的核电池提供动力,下列关于${\;}_{94}^{238}$Pu的说法正确的是( )
| A. | 质量数为94 | B. | 中子数为144 | C. | 质子数为238 | D. | 电子数为144 |
16.如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为( )
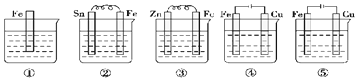

| A. | ⑤②①③④ | B. | ③②⑤④① | C. | ⑤④③②① | D. | ⑤②①④③ |
3.下列各组物质按化合物、单质和混合物顺序排列的是( )
| A. | 烧碱、氧气、碘酒 | B. | 小苏打、石灰水、二氧化硫 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、胆矾 |
20.部分短周期元素的原子结构及相关性质如表所示:
(1)T在元素周期表中的位置为第三周期第ⅥA族.
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为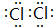 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
(2)X的一种同位素可用于测定文物年代,该同位素为614C (用原子符号表示).
(3)Z单质的电子式为
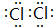 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).(4)Z与T相比,非金属性较强的是Cl(用元素符号表示),下列能证明这一事实的是d(填字母)
a.常温下,Z单质为气体,T单质为固体 b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高 d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为HCl+NH3=NH4Cl,产物中含有的化学键类型为离子键、共价键.