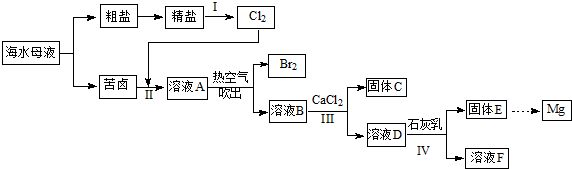
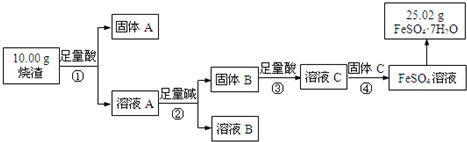
题目内容
7.现有S2-、SO32-、NH4+、Al3+、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,按要求填空:(1)在水溶液中,该离子水解呈碱性的是S2-、SO32-、AlO2-、HCO3-.
(2)在水溶液中,该离子水解呈酸性的是NH4+、Al3+、Fe3+.
(3)既能在酸性较强的溶液中大量存在,又能在碱性较强的溶液中大量存在的是Na+、SO42-、Cl-.
(4)既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在的是HCO3-.
分析 (1)弱酸根离子水解显碱性;
(2)弱碱离子水解显碱性;
(3)与氢离子、氢氧根离子均不反应的离子,可大量共存;
(4)与酸、碱均反应的离子,为酸式酸根离子,不能大量存在.
解答 解:(1)S2-、SO32-、AlO2-、HCO3-属于弱酸根离子,水解显碱性,
故答案为:S2-、SO32-、AlO2-、HCO3-;
(2)NH4+、Al3+、Fe3+均属于弱碱阳离子,水解显酸性,
故答案为:NH4+、Al3+、Fe3+;
(3)既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在的离子,是和氢离子、氢氧根离子都不反应的离子,强酸的酸根离子和强碱的阳离子,为Na+、SO42-、Cl-,
故答案为:Na+、SO42-、Cl-.
(4)与酸、碱均反应的离子,为弱酸的酸式酸根离子,不能大量存在,即HCO3-既不能在酸性较强的溶液中大量存在,又不能在碱性较强的溶液中大量存在,
故答案为:HCO3-.
点评 本题考查盐类水解及离子共存,把握盐类水解原理及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.短周期元素甲和乙,甲原子的最外层电子数为a,次外层电子数为b;乙原子的M层电子数为(a-b),L层电子数为(a+b).则甲、乙两元素形成的化合物具有的性质是( )
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |
17.能源、材料已成为当今科学研究的热点.请回答下列问题:
(1)单质A的燃烧热大,可作燃料.已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示.若该原子核外电子有三层,则该元素位于周期表ⅡA族,写出A燃烧后形成的氧化物的电子式: .
.

(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是Al(填元素符号),其原子最外层有3种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为正四面体,该物质为非极性分子(选填“极性”或“非极性”).
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2 (g)△H=-150.72kJ/mol.
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应.下列叙述正确的是b(选填编号).
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少$\frac{2}{3}$
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2.
(1)单质A的燃烧热大,可作燃料.已知A为短周期元素,其气态原子逐个失去1~4个电子所需能量(电离能)如表所示.若该原子核外电子有三层,则该元素位于周期表ⅡA族,写出A燃烧后形成的氧化物的电子式:
 .
.| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 738 | 1451 | 7733 | 10540 | … |

(2)如图是超导材料元素在周期表中的分布,上述元素的短周期元素中原子半径最大的是Al(填元素符号),其原子最外层有3种运动状态不同的电子,写出其最高价氧化物对应水化物在水溶液中的电离方程式:H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)上述主族元素中有两种原子可以形成的五核分子,其化学键键长和键角都相等,则该分子的空间构型为正四面体,该物质为非极性分子(选填“极性”或“非极性”).
(4)铁单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1mol该易燃气体放出37.68kJ热量,请写出此反应的热化学方程式:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2 (g)△H=-150.72kJ/mol.
(5)取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应.下列叙述正确的是b(选填编号).
a.Mg作负极,Al作正极
b.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少$\frac{2}{3}$
c.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2.