题目内容
16.有关下列图示的说法中正确的是( )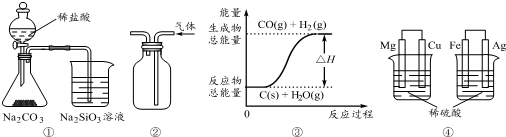
| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集NO2气体 | |
| C. | 图③表示可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H小于0 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同 |
分析 A.盐酸易挥发,盐酸与硅酸钠反应;
B.NO2的密度比空气密度大;
C.由图可知,生成物总能量高;
D.Mg、Fe均为负极,失去电子均转化为二价金属阳离子.
解答 解:A.盐酸易挥发,盐酸与硅酸钠反应,则该装置发生强酸制取弱酸的反应,但不能比较C、Si的非金属性,故A错误;
B.NO2的密度比空气密度大,利用图中向上排空气法可收集,故B正确;
C.由图可知,生成物总能量高,则可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H大于0,故C错误;
D.Mg、Fe均为负极,失去电子均转化为二价金属阳离子,则两个装置中通过导线的电子数相同时,消耗负极材料的物质的量相同,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及酸性比较、气体收集、反应中能量变化及原电池等,综合性较强,把握相关反应原理、实验技能、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
6.NaH是一种离子化合物,与水反应时生成烧碱和氢气,它也能与乙醇,液氨等反应产生氢气.下列有关NaH的叙述正确的是( )
| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
7.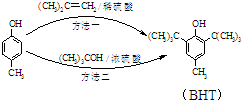 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从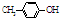 出发合成BHT的方法有如图两种.下列说法错误的是
出发合成BHT的方法有如图两种.下列说法错误的是
(BHT)( )
 BHT是一种常用的食品抗氧化剂,从
BHT是一种常用的食品抗氧化剂,从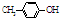 出发合成BHT的方法有如图两种.下列说法错误的是
出发合成BHT的方法有如图两种.下列说法错误的是(BHT)( )
| A. | BHT与 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| B. | BHT在水中的溶解度小于苯酚 | |
| C. | 两种方法的反应类型都是加成反应 | |
| D. | 从绿色化学角度分析方法一优于方法二 |
11.氨是最重要的化工产品之一.
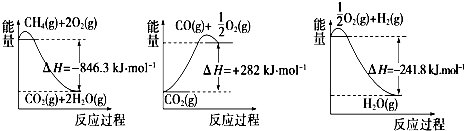
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.
(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
①你认为该溶液呈碱(填“酸”、“中”或“碱”性).
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g)?CO(g)+3H2(g).有关化学反应的能量变化如图所示.CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1.

(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l)△H<0.吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是B.(填字母)
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)△H<0.某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%.该温度下此反应平衡常数K的值为2500 L2•mol-2.
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如表:现有常温下0.1mol•L-1的(NH4)2CO3溶液,
| 弱电解质 | H2CO3 | NH3•H2O |
| Ka1 | 4.30×10-7 | 1.77×10-5 |
| Ka2 | 5.61×10-11 |
②就该溶液中粒子之间有下列关系式,你认为其中不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H3O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
1.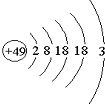 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In为过渡金属元素 | ||
| C. | In容易导电导热 | D. | In在反应中容易失电子 |
20.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,向两个烧杯中分别加入1mol两种金属充分反应后,天平依然平衡,则这两种金属是( )
| A. | Mg和Al | B. | Al和Fe | C. | Fe和Cu | D. | Na和Mg |