题目内容
6.NaH是一种离子化合物,与水反应时生成烧碱和氢气,它也能与乙醇,液氨等反应产生氢气.下列有关NaH的叙述正确的是( )| A. | 跟水反应时,水作氧化剂 | |
| B. | NaH中阳离子半径大于阴离子半径 | |
| C. | 跟液氨反应时,生成氢气外,还生成铵盐 | |
| D. | 与乙醇反应时,放出氢气的速率比与水反应时更快 |
分析 A.NaH+H2O═NaOH+H2↑中,NaH中的H元素由-1价升高为0,水中的H元素由+1价降低为0;
B.NaH中阳离子原子核外有2个电子层,阴离子核外有1个电子层;
C.根据方程式NaH+NH3═NaNH2+H2↑判断;
D.乙醇O-H键难以断裂.
解答 解:A.跟水反应时,水中含元素的化合价降低,水作氧化剂,故A正确;
B.NaH中阳离子原子核外有2个电子层,阴离子核外有1个电子层,则阳离子半径大于阴离子半径,故B正确;
C.氢化钠和液氨反应方程式为NaH+NH3═NaNH2+H2↑,故C错误;
D.乙醇O-H键难以断裂,放出氢气的速率比与水反应时慢,故D错误.
故选AB.
点评 本题考查氧化还原反应,明确反应中元素的化合价变化及氧化还原反应中的概念即可解答,题目难度不大.

练习册系列答案
相关题目
16.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 除去淀粉中NaCl杂质,可将混合物加水溶解后,用渗析的方法分离 |
17.常温下,下列离子浓度的关系正确的是( )
| A. | 0.2mol•L-1的CH3COONa溶液中c(CH3COO-)=a mol•L-1,0.1mol•L-1的CH3COONa溶液中c(CH3COO-)=b mol•L-1,则有a=2b | |
| B. | 0.2mol•L-1的CH3COONa溶液与0.1mol•L-1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 相同物质的量浓度的下列溶液中,c(NH4+)由大到小的顺序:(NH4)2SO4>(NH4)2CO3>NH4Cl>NH4HCO3 | |
| D. | 0.1mol•L-1的HCN(弱酸)和0.1mol•L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)═c(Na+)+c(H+) |
11.下列说法正确的是( )
| A. | 对于△S>0的反应,若在任何温度下均能自发进行,则该反应△H>0 | |
| B. | 氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转换率高 | |
| C. | 合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0,加入催化剂能加快反应速率并提高转化率 | |
| D. | Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+═SO42-+3S↓+H2O |
18.下列状态的物质,既能导电又属于电解质的是( )
| A. | MgCl2晶体 | B. | 熔融的KOH | C. | 液态HCl | D. | NaCl溶液 |
16.有关下列图示的说法中正确的是( )
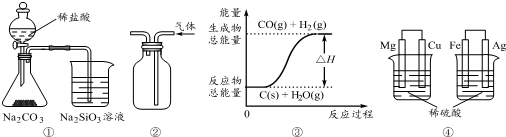

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集NO2气体 | |
| C. | 图③表示可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H小于0 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同 |
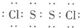 ,其晶体类型为分子晶体.
,其晶体类型为分子晶体.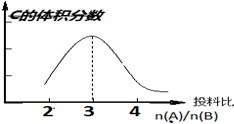 在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示:
在恒温恒压条件下:aA(g)+bB(g)?2C(g),以不同的投料比开始反应,分别达到平衡时,C的体积分数与投料比的关系如图所示: