题目内容
4.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu.(1)上述反应产物Cu2HgI4中,Cu元素显+1价.
(2)以上反应中的氧化剂为CuI,还原产物是Cu当有1molCuI参与反应时,转移电子1mol.
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:Cu2++I-→CuI+I3-
(4)某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
在①、②、③反应中一定不可能实现的是②;若①能发生,还原性最强的是NO(填化学式)
分析 (1)根据化合价代数和为0计算;
(2)Cu元素化合价部分由+1价降低到0价,被还原,CuI为氧化剂,Cu是还原产物,计算生成Cu的物质的量,根据Cu元素化合价变化计算转移电子;
(3)从电荷守恒和电子守恒的角度配平离子方程式;
(4)根据氧化还原反应中元素化合价的升降相等判断;
根据还原剂的还原性大于还原产物的还原性进行判断.
解答 解:(1)Cu2HgI4中,Hg元素显+2价,I元素显-1价,设Cu2HgI4中铜元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x×2+(+2)+(-1)×4=0,则x=+1价;
故答案为:+1;
(2)在反应4CuI+Hg═Cu2HgI4+2Cu中,CuI中Cu元素的化合价由+1价降为0价,为氧化剂,Cu是还原产物,2molCuI参加反应生成Cu的物质的量为1mol,则转移电子为1mol,
故答案为:CuI;Cu;1;
(3)Cu2+与I-直接反应制得CuI的反应中,得电子,Cu化合价由+2价降为+1价,失电子,I化合价由-1价升高为0价,根据氧化还原反应氧化剂和还原剂得失电子数目相等,则有2molCu2+参加反应生成1molI3-,反应的离子方程式为2Cu2++5I-=2CuI+I3-,
故答案为:2Cu2++5I-=2CuI+I3-;
(4)②中N元素化合价只升高,不符合氧化还原反应的原理,一定不能发生;在反应①NO+HNO3→N2O3+H2O中NO作还原剂,反应中NO的还原性最强,
故答案为:②;NO.
点评 本题考查氧化还原反应基本概念、配平、计算等,侧重于学生的分析能力的考查,注意从化合价的变化角度理解有关概念,难度不大

练习册系列答案
相关题目
12.下列有关实验的说法正确的是( )
| A. | 用干燥的pH试纸测定新制氯水的pH | |
| B. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS) |
9.室温下,下列溶液中粒子的物质的量浓度关系正确的是 (?)
| A. | 0.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(OH-) | |
| B. | 浓度均为0.1 mol/L的 ①NH4Cl ②NH4HSO4③NH4HCO3三种溶液,其中c(NH4+):③>①>② | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 0.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
16.有关下列图示的说法中正确的是( )
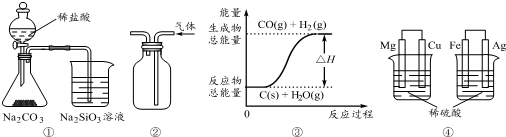

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集NO2气体 | |
| C. | 图③表示可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H小于0 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同 |
8.下列鉴别空气、氧气和二氧化碳3瓶气体的方法中,正确的是( )
| A. | 闻气味 | B. | 观察颜色 | C. | 加澄清石灰水 | D. | 插入燃着木条 |
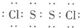 ,其晶体类型为分子晶体.
,其晶体类型为分子晶体.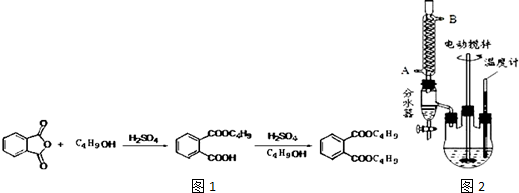
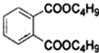 +2NaOH$\stackrel{加热}{→}$
+2NaOH$\stackrel{加热}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.