题目内容
20.在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,向两个烧杯中分别加入1mol两种金属充分反应后,天平依然平衡,则这两种金属是( )| A. | Mg和Al | B. | Al和Fe | C. | Fe和Cu | D. | Na和Mg |
分析 盐酸足量,则金属完全反应,天平依然平衡,说明烧杯中增加的质量相同,结合金属与酸反应生成氢气的质量判断溶液的增重,可确定金属,以此解答.
解答 解:题中金属与酸反应生成氢气的关系式分别为Mg~H2、2Al~3H2、Fe~H2、2Na~H2,分别加入1mol两种金属充分反应后,则
A.Mg与盐酸反应增加质量为24-2=22g,Al与盐酸反应增加的质量为27-3=24g,故A不选;
B.Al与盐酸反应增加的质量为27-3=24g,Fe与盐酸反应增加的质量为56-2=54g,故B不选;
C.Fe与盐酸反应增加的质量为56-2=54g,Cu与盐酸不反应,烧杯中增重为64g,故C不选;
D.Na与盐酸反应增加质量为23-1=22g,Mg与盐酸反应增加质量为24-2=22g,故D选;
故选D.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握反应的关系式或方程式,根据方程式计算生成氢气的质量与金属质量的关系为解答该题的关键,难度中等.

练习册系列答案
相关题目
16.有关下列图示的说法中正确的是( )
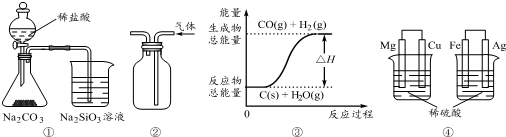

| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集NO2气体 | |
| C. | 图③表示可逆反应C(s)+H2O(g)?CO(g)+H2(g)的△H小于0 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同 |
8.下列鉴别空气、氧气和二氧化碳3瓶气体的方法中,正确的是( )
| A. | 闻气味 | B. | 观察颜色 | C. | 加澄清石灰水 | D. | 插入燃着木条 |
15.两串联电解池,左边放硫酸铜,右边放一定量的某硝酸盐溶液,电解时当左池有1.6gCu析出时,右池析出0.45g固体,则右池溶质为( )
| A. | AgNO3 | B. | NaNO3 | C. | Mg(NO3)2 | D. | Al(NO3)3 |
5.除去下列物质中所含的杂质(括号内为杂质),将选用的试剂和有关离子方程式填在题后的横线上.
| 混合物成分 | 提纯试剂 | 离子方程式 |
| ①FeCl2溶液(FeCl3) | ||
| ②FeCl3溶液(FeCl2) | ||
| ③Na2CO3溶液(NaHCO3) | ||
| ④Fe2O3(Al2O3) |
9.下列溶液一定呈中性的是( )
| A. | pH=7的溶液 | |
| B. | 氨水和硫酸铵的混合液中c(NH4+)=2c(SO42-) | |
| C. | c(H+)=10-7 mol•L-1的溶液 | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-14的溶液 |