题目内容
8.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 1mol Cu与足量稀硝酸反应产生NA个NO分子 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 | |
| C. | 通常条件下,7.1g 37Cl2含中子数为4.0NA | |
| D. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.2NA |
分析 A.依据氧化还原反应电子守恒分析计算;
B.物质的量浓度中体积为溶液体积;
C.37Cl2的摩尔质量为74g/mol,1mol37Cl2中含有40mol中子;
D.根据n=$\frac{m}{M}$计算出镁的物质的量,再根据电子守恒计算出转移电子数目.
解答 解:A.铜元素化合价从0价变化为+2价,氮元素化合价从+5价变化为+2价,依据电子守恒得到,3mol Cu与足量稀硝酸反应产生2NA个NO分子,故A错误;
B.含NA个Na+的Na2O溶解于1L水中,溶液体积不是1L,则Na+的物质的量浓度不等于1mol•L-1,故B错误;
C.7.1g 37Cl2的物质的量为:$\frac{7.1g}{74g/mol}$=$\frac{7.1}{74}$mol,含有的中子数为$\frac{7.1}{74}$×4×NA,故C错误;
D.2.4g镁的物质的量为0.1mol,0.1mol镁与足量氧气反应失去0.2mol电子,转移的电子数为0.2NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,明确物质的量、摩尔质量等化学量与阿伏加德罗常数的关系为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列除杂(括号内是杂质)所选用的试剂及操作方法均正确的一组是( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | CO2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| B | Mg(Al) | 过量稀盐酸 | 过滤 |
| C | FeCl2溶液(FeCl3) | 足量Fe粉 | 过滤 |
| D | CO2(CO) | O2 | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
19.常温下,下列有关叙述正确的是( )
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-5mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ | |
| D. | 10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL |
3.下列图象不正确的是( )
| A. |  向100mL 0.1mol•L-1H2SO4溶液中滴加0.1mol•L-1Ba(OH)2溶液至过量 | |
| B. |  向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 | |
| C. |  向一定浓度的氯化钠溶液中加水 | |
| D. |  向蒸馏水中通入HCl气体 |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol环丙烷中含有共价键的数目为NA | |
| B. | 0.1molCl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 2.24LSO3中含有氧原子的数目为0.3NA | |
| D. | 9.2g由乙醇和二甲醚(CH3OCH3)组成的混合物中含有氧原子的数目为0.2NA |
20.下列实验操作不正确的是 (填序号)
| A. | 取少量卤代烃加入NaOH水溶液共热,冷却,再加入AgNO3溶液检验卤代烃中卤原子的存在 | |
| B. | 实验室制乙烯时,为防止暴沸,应加入沸石 | |
| C. | 用溴水检验汽油中是否含有不饱和脂肪烃 | |
| D. | 用酸性KMnO4溶液直接检验乙醇与浓硫酸反应是否得到乙烯 | |
| E. | 用燃烧的方法鉴别甲烷与乙炔 | |
| F. | 用无水硫酸铜检验乙醇中是否含水 | |
| G. | 取蔗糖在稀硫酸作用下的水解液于一洁净的试管中,加入银氨溶液,水浴加热即可生成银镜 |
13.甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是( )
| A. | 常温下,1 mol/L甲酸溶液中的c(H+)约为1×10-2mol•L-1 | |
| B. | 甲酸能与碳酸钠反应放出二氧化碳 | |
| C. | 10 mL 1 mol•L-1甲酸溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸溶液与锌反应比强酸溶液与锌反应缓慢 |

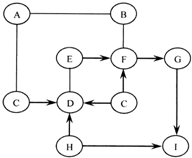 图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的.
图中A~I是初中化学常见的物质,且分别是由H、C、O、Na、Al、S、Ca、Cu、Ag中的一种或几种元素组成的.