题目内容
4.下列有关比较中正确的是( )| A. | 第一电离能:P>S | B. | 气态氢化物的稳定性:CH4>NH3 | ||
| C. | 电负性:CI>F | D. | 最高正化合价:F>S |
分析 A.P的3p处于半满状态;
B.非金属性越强,气态氢化物越稳定;
C.同一主族,自下而上,电负性逐渐增强;
D.F是电负性最强的元素,没有正化合价.
解答 解:A.P的3p处于半满状态,P的第一电离能大于S,故A正确;
B.非金属性N>C,气态氢化物的稳定性CH4<NH3,故B错误;
C.同一主族,自下而上,电负性逐渐增强,因此电负性F>Cl,故C错误;
D.S的最高正价为+6,F是电负性最强的元素,没有正化合价,故D错误;
故选A.
点评 本题主要考查元素性质的变化规律,掌握规律即可完成,难度中等,需要注意的F是电负性最强的元素,没有正化合价.

练习册系列答案
相关题目
14.下列有关说法中,不正确的是( )
| A. | 煤干馏后的产物可以制造氮肥 | |
| B. | 可在周期表的过渡元素中寻找半导体材料 | |
| C. | 可用新制的氢氧化铜检验葡萄糖 | |
| D. | 可用氯气制备漂白粉 |
12.如图所示,6个编号分别代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁).图中⑤表示的物质是( )
a.Al b.Fe2O3 c.NaOH 溶液 d.Cl2 e.NH3 f.氢碘酸溶液.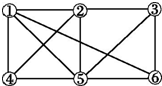
a.Al b.Fe2O3 c.NaOH 溶液 d.Cl2 e.NH3 f.氢碘酸溶液.

| A. | a 或b | B. | c | C. | d 或e | D. | f |
9.下列性质比较中不正确的是( )
| A. | 沸点:CBr4>CF4 | B. | 水溶性:HBr>Br2 | ||
| C. | 硬度:镁>镁铝合金 | D. | 熔点:金刚石>NaCl |
13.下列物质性质与应用对应关系错误的是( )
| A. | 氧化镁的熔点高,可用作耐火材料 | |
| B. | 碳酸钠具有弱碱性,可用作胃酸中和剂 | |
| C. | 二氧化硫具有漂白性,可用作漂白纸浆 | |
| D. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 |

 .
.
 ,写出B的化学式:Fe3O4,写出C的化学式:Al2O3,主要成分是J的矿石的名称:赤铁矿.
,写出B的化学式:Fe3O4,写出C的化学式:Al2O3,主要成分是J的矿石的名称:赤铁矿.