题目内容
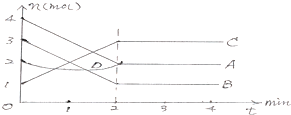
 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.a=12.5时,醋酸与氢氧化钠恰好反应生成醋酸钠,溶液显示碱性,根据电荷守恒判断钠离子与醋酸根离子的浓度大小;
B.当加入的醋酸量减少时,则可能存在c (OH-)>c (CH3COO-);
C.D点时醋酸的物质的量为氢氧化钠物质的量的2倍,根据混合液中物料守恒进行判断;
D.C点时溶液的pH=7,根据电荷守恒判断溶液中离子浓度大小.
B.当加入的醋酸量减少时,则可能存在c (OH-)>c (CH3COO-);
C.D点时醋酸的物质的量为氢氧化钠物质的量的2倍,根据混合液中物料守恒进行判断;
D.C点时溶液的pH=7,根据电荷守恒判断溶液中离子浓度大小.
解答:
解:A.a=12.5时,醋酸与氢氧化钠的物质的量相等,二者恰好反应生成醋酸钠,溶液显示碱性,则c (OH-)>c (H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可得:c (Na+)>c (CH3COO-),故A错误;
B.在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由于溶液显示碱性,则c(OH-)>c(H+),当氢氧化钠足量,醋酸量很少时,离子浓度可能为:c (Na+)>c (OH-)>c (CH3COO-)>c (H+),溶液中不一定满足c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.在D点时,加入25mL醋酸,则醋酸的物质的量是氢氧化钠物质的量的2倍,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0.05mol/L,则c(CH3COO-)+c(CH3COOH)=2c(Na+),故C错误;
D.在C点溶液的pH=7,溶液显中性,则c(OH-)=c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故D正确;
故选D.
B.在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由于溶液显示碱性,则c(OH-)>c(H+),当氢氧化钠足量,醋酸量很少时,离子浓度可能为:c (Na+)>c (OH-)>c (CH3COO-)>c (H+),溶液中不一定满足c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B错误;
C.在D点时,加入25mL醋酸,则醋酸的物质的量是氢氧化钠物质的量的2倍,根据物料守恒可得:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,c(Na+)=0.05mol/L,则c(CH3COO-)+c(CH3COOH)=2c(Na+),故C错误;
D.在C点溶液的pH=7,溶液显中性,则c(OH-)=c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),故D正确;
故选D.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度大小比较,题目难度中等,注意掌握酸碱混合的定性判断方法,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断溶液中各离子浓度大小,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列说法不正确的是( )
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
下列对有机物结构或性质的描述,错误的是( )
| A、乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O |
| B、光照下2,2-二甲基丙烷与Br2蒸气反应,其一溴取代物只有一种 |
C、某有机物球棍结构模型如右图,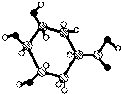 则该有机物能发生消去反应和氧化反应 则该有机物能发生消去反应和氧化反应 |
| D、二十碳五烯酸和二十二碳六烯酸是鱼油的主要成分,它们含有相同的官能团,是同系物,化学性质相似 |
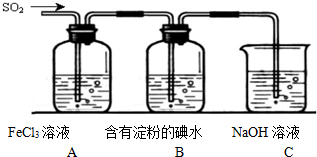
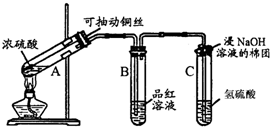
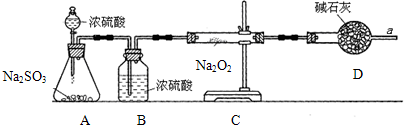
下列各图所示装置,肯定不符合气密性要求的是( )
A、 |
B、 |
C、 |
D、 |
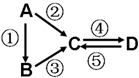
对于如图,下列说法正确的是( )

| A、该反应的方程式为:2A+2B?2C+D |
| B、该反应的方程式为:2A+2B=2C 催化剂是D |
| C、该反应是从正反应方向开始的 |
| D、平衡时,V(A)正=V(B)逆=V(C)逆 |
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: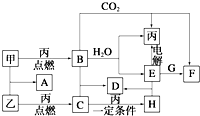 甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:
甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题: