题目内容
下列说法不正确的是( )
| A、在NaHCO3溶液中有:C(CO32-)+C(OH-)=C(H+)+C(H2CO3) |
| B、FeCl3溶液中存在:Fe3++3H2O?Fe(OH)3+3H+ 的水解平衡,给该溶液里加少量HCl或NaOH溶液,都能使该平衡向左移动 |
| C、乙酸乙酯的制取实验中,试剂加入的顺序是:无水乙醇→浓硫酸→冰醋酸 |
| D、实验室制取甲烷的原理是:无水醋酸钠和碱石灰共热,其中碱石灰的成分是NaOH和CaO |
考点:离子浓度大小的比较,盐类水解的应用
专题:基本概念与基本理论
分析:A.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
B.向溶液中加入少量HCl或NaOH,都改变溶液中氢离子浓度,导致平衡移动;
C.制取乙酸乙酯时,防止乙酸挥发,最后加乙酸;
D.无水醋酸钠和氢氧化钠反应生成甲烷.
B.向溶液中加入少量HCl或NaOH,都改变溶液中氢离子浓度,导致平衡移动;
C.制取乙酸乙酯时,防止乙酸挥发,最后加乙酸;
D.无水醋酸钠和氢氧化钠反应生成甲烷.
解答:
解:A.任何电解质溶液中都存在质子守恒,根据质子守恒得C(CO32-)+C(OH-)=C(H+)+C(H2CO3),故A正确;
B.向溶液中加入少量HCl,溶液中氢离子浓度增大抑制铁离子水解,加入NaOH,铁离子和氢氧根离子反应生成氢氧化铁沉淀,抑制铁离子水解,从而导致平衡向左移动,故B正确;
C.取乙酸乙酯时,防止乙酸挥发,最后加乙酸,则试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸,故C正确;
D.无水醋酸钠和氢氧化钠反应生成甲烷,方程式为CH3COONa+NaOH
Na2CO3+CH4↑,故D错误;
故选D.
B.向溶液中加入少量HCl,溶液中氢离子浓度增大抑制铁离子水解,加入NaOH,铁离子和氢氧根离子反应生成氢氧化铁沉淀,抑制铁离子水解,从而导致平衡向左移动,故B正确;
C.取乙酸乙酯时,防止乙酸挥发,最后加乙酸,则试剂加入的顺序是:先加入乙醇,后慢慢加入浓硫酸,最后加入乙酸,故C正确;
D.无水醋酸钠和氢氧化钠反应生成甲烷,方程式为CH3COONa+NaOH
| △ |
故选D.
点评:本题考查离子浓度大小比较、盐类水解、物质制备等知识点,明确物质的性质是解本题关键,知道乙酸乙酯、甲烷制备原理,注意C选项中加入物质顺序,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、一定温度下,某溶液的pH<7,则该溶液呈酸性 |
| B、在水中加入少量碳酸钠固体将抑制水的电离 |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2 c(OH-)+c(CH3COO-) |
| D、浓度均为0.1mol/L的NH4Cl溶液和NH4HSO4溶液,前者的c(NH4+)大于后者 |
 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
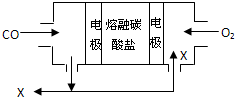 用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )
用熔融碳酸盐作电解质,CO、O2为原料组成的新型燃料电池如图所示,为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参与循环.下列说法错误的是( )| A、X物质的化学式为CO2 |
| B、通入O2的电极为正极 |
| C、负极的电极反应式为CO+CO32--2e-=2CO2 |
| D、电池工作时,转移0.5mol电子,理论上消耗O22.8L |
常温下,下列叙述不正确的是( )
| A、在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a<b |
| B、在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH<8.0 |
| D、若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
1mol某烷烃完全燃烧消耗的O2为1l mol,则其主链上含有5个碳原子的同分异构体(不考虑空间异构)有( )
| A、4种 | B、5种 | C、6种 | D、7种 |
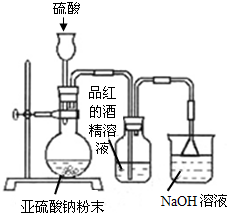 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.