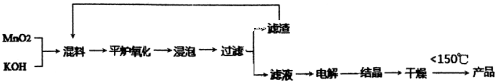
题目内容
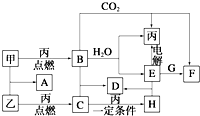 甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:
甲、乙、丙为常见单质.A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色.在一定条件下,各物质相互转化关系如图所示.请回答下列问题:(1)用化学式表示:丙为
(2)A的电子式为
(3)电解E的水溶液时,E起到的作用是
(4)写出B+C-→D的化学方程式:
考点:无机物的推断
专题:推断题
分析:甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,均含有Na元素,B能与二氧化碳、水反应生成单质丙,则B为Na2O2,丙为O2,A为Na,E为NaOH,F为Na2CO3,G的焰色反应为黄色,与氢氧化钠反应得到碳酸钠,判断G为NaHCO3;C能使品红溶液褪色,由单质乙与氧气反应得到,则乙为S,A为Na2S,C为SO2,H为SO3,D为Na2SO4,据此解答.
解答:
解:甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,均含有Na元素,B能与二氧化碳、水反应生成单质丙,则B为Na2O2,丙为O2,A为Na,E为NaOH,F为Na2CO3,G的焰色反应为黄色,与氢氧化钠反应得到碳酸钠,判断G为NaHCO3;C能使品红溶液褪色,由单质乙与氧气反应得到,则乙为S,A为Na2S,C为SO2,H为SO3,D为Na2SO4,
(1)由上述分析可知,丙为O2,H为SO3,故答案为:O2;SO3;
(2)A为Na2S,电子式为 ,故答案为:
,故答案为: ;
;
(3)电解NaOH的水溶液时,实质是电解水,NaOH起到的作用是:增强溶液导电能力,故答案为:增强溶液导电能力;
(4)B+C→D是过氧化钠与二氧化硫反应生成硫酸钠,反应化学方程式为:Na2O2+SO2=Na2SO4;
B和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:Na2O2+SO2=Na2SO4;HCO3-+OH-=CO32-+H2O.
(1)由上述分析可知,丙为O2,H为SO3,故答案为:O2;SO3;
(2)A为Na2S,电子式为
 ,故答案为:
,故答案为: ;
;(3)电解NaOH的水溶液时,实质是电解水,NaOH起到的作用是:增强溶液导电能力,故答案为:增强溶液导电能力;
(4)B+C→D是过氧化钠与二氧化硫反应生成硫酸钠,反应化学方程式为:Na2O2+SO2=Na2SO4;
B和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:Na2O2+SO2=Na2SO4;HCO3-+OH-=CO32-+H2O.
点评:本题考查无机物推断,颜色反应性质、转化关系中特殊转化等是推断突破口,需要学生熟练掌握元素化合物知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列原子各电子层中电子数不合理的是( )
| A、Sc:K(2)L(8)M(8)N(3) |
| B、Cr:K(2)L(8)M(13)N(1) |
| C、Ge:K(2)L(8)M(18)N(4) |
| D、Cu:K(2)L(8)M(18)N(1) |
 25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )
25℃时,在25mL0.1mol/L的氢氧化钠溶液中,逐滴加入0.2mol/LCH3COOH,溶液的pH的变化曲线如图所示,下列分析的结论正确的是( )| A、若B点的横坐标a=12.5,且有c(Na+)=c(CH3COO-) |
| B、对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C、D点时,c(CH3COO-)+c(CH3COOH)=c(Na+) |
| D、C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
 已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收). ,该氧化物的化学式为
,该氧化物的化学式为 有关元素A、B、C、D的信息如下:
有关元素A、B、C、D的信息如下: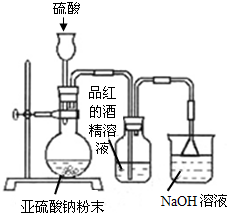 某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发.为了探究二氧化硫漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验.请回答相关问题.