题目内容
实验室需配制 100mL 1.5mol/L NaOH 溶液,下列叙述正确的是( )
| A、转移液体时,玻璃棒应紧靠容量瓶口 |
| B、容量瓶上标有温度、浓度、容积和压强 |
| C、将所需的6.0g氢氧化钠固体倒入到容量瓶中溶解 |
| D、定容时若俯视刻度线观察液面,会使所配制的NaOH 溶液的浓度偏高 |
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:A.转移液体时,玻璃棒应紧靠容量瓶内壁;
B.容量瓶上没有标志浓度、压强;
C.氢氧化钠溶解放出大量热,不能再容量瓶溶解配制;
D.定容时若俯视刻度线观察液面,导致溶液的体积偏小.
B.容量瓶上没有标志浓度、压强;
C.氢氧化钠溶解放出大量热,不能再容量瓶溶解配制;
D.定容时若俯视刻度线观察液面,导致溶液的体积偏小.
解答:
解:A.移液体时,玻璃棒应紧靠容量瓶内壁,故A错误;
B.容量瓶上标有温度、刻度线、容积,故B错误;
C.氢氧化钠溶解放出大量热,不能再容量瓶溶解配制,应该先在烧杯中溶解,在转移到容量瓶,故C错误;
D.定容时若俯视刻度线观察液面,导致溶液的体积偏小,依据C=
,可知溶液体积偏小,溶液浓度偏高,故D正确;
故选:D.
B.容量瓶上标有温度、刻度线、容积,故B错误;
C.氢氧化钠溶解放出大量热,不能再容量瓶溶解配制,应该先在烧杯中溶解,在转移到容量瓶,故C错误;
D.定容时若俯视刻度线观察液面,导致溶液的体积偏小,依据C=
| n |
| V |
故选:D.
点评:本题考查了配制一定物质的量浓度溶液,明确配制原理和步骤是解题关键,注意容量瓶的使用注意事项和误差分析的方法,为考试热点.

练习册系列答案
相关题目
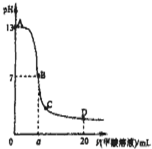 向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )
向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )| A、在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+) |
| D、在D点:c(HCOO-)+c(HCOOH)>2c(K+) |
实验室制取的气体不能用浓硫酸干燥的是( )
| A、O2 |
| B、Cl2 |
| C、SO2 |
| D、NH3 |
化学与生活息息相关.下列叙述错误的是( )
| A、明矾溶液可以对自来水进行净水 |
| B、电解法精炼粗铜,纯铜做阴极 |
| C、铅蓄电池的负极是Pb |
| D、增大压强平衡一定发生移动 |

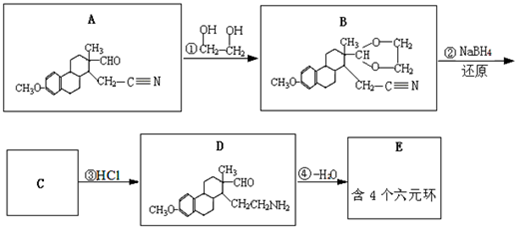
 (提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)
(提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)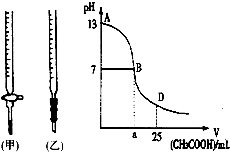 图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答:
图为向25mL0.1mol?L-1NaOH溶液中逐渐滴加0.2mol?L-1CH3COOH溶液过程中,用pH计跟踪测出溶液pH的变化曲线,请回答: