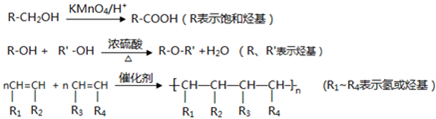
题目内容
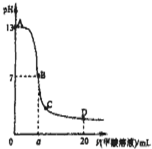 向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )
向15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确的是( )| A、在A、B间任意一点c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>c(OH-)>c(H+) |
| D、在D点:c(HCOO-)+c(HCOOH)>2c(K+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:A、在A、B间任意一点,溶液呈碱性,则c(OH-)>c(H+).
B、B点,溶液呈中性,则c(OH-)=c(H+),甲酸钾是强碱弱酸盐,要使溶液呈中性,酸的物质的量应该稍微大于碱;
C、C点,pH<7,溶液呈酸性;
D、D点醋酸过量,所加入醋酸的物质的量大于KOH的物质的量.
B、B点,溶液呈中性,则c(OH-)=c(H+),甲酸钾是强碱弱酸盐,要使溶液呈中性,酸的物质的量应该稍微大于碱;
C、C点,pH<7,溶液呈酸性;
D、D点醋酸过量,所加入醋酸的物质的量大于KOH的物质的量.
解答:
解:A、在A、B间任意一点,因为开始时c(OH-)>c(HCOO-),即也有可能是c(K+)>c(OH-)>c(HCOO-)>c(H+),故A错误;
B、B点,溶液呈中性,则c(OH-)=c(H+),甲酸钾是强碱弱酸盐,要使溶液呈中性,酸的物质的量应该稍微大于碱,所以a>7.5,故B错误;
C、C点,pH<7,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(HCOO-)+c(OH-)=c(H+)+c(K+),所以得c(HCOO-)>c(K+),故C错误;
D、D点醋酸过量,所加入醋酸的物质的量为0.02L×0.2mol/L═0.004mol,
KOH的物质的量为0.015L×0.1mol/L=0.0015mol,则反应后c(CH3COO-)+c(CH3COOH)>2c(K+),故D正确.
故选D.
B、B点,溶液呈中性,则c(OH-)=c(H+),甲酸钾是强碱弱酸盐,要使溶液呈中性,酸的物质的量应该稍微大于碱,所以a>7.5,故B错误;
C、C点,pH<7,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(HCOO-)+c(OH-)=c(H+)+c(K+),所以得c(HCOO-)>c(K+),故C错误;
D、D点醋酸过量,所加入醋酸的物质的量为0.02L×0.2mol/L═0.004mol,
KOH的物质的量为0.015L×0.1mol/L=0.0015mol,则反应后c(CH3COO-)+c(CH3COOH)>2c(K+),故D正确.
故选D.
点评:本题考查了酸碱混合溶液定性判断,根据溶液中的溶质及其性质是解本题关键,结合电荷守恒及物料守恒来分析解答,易错选项是D.

练习册系列答案
相关题目
实验室需配制 100mL 1.5mol/L NaOH 溶液,下列叙述正确的是( )
| A、转移液体时,玻璃棒应紧靠容量瓶口 |
| B、容量瓶上标有温度、浓度、容积和压强 |
| C、将所需的6.0g氢氧化钠固体倒入到容量瓶中溶解 |
| D、定容时若俯视刻度线观察液面,会使所配制的NaOH 溶液的浓度偏高 |
已知某温度下0.1moL/L的NaHB溶液中c(H+)>c(OH-),则下列关系式一定正确的是( )
| A、c(H+)+c(Na+)=c(HB-)+c(B2-)+c(OH-) |
| B、c(Na+)=0.1 moL/L≥c(B2-) |
| C、c(H+)×c(OH-)=1×10-14 |
| D、溶液的pH=1 |
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+Q kJ?mol-1mol(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是( )
| A、反应过程中,若增大压强能提高SiCl4的转化率 |
| B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C、当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应 |
| D、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L?min) |

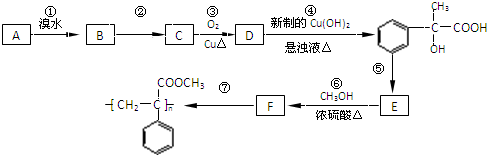
 为原料合成重要的化工产品
为原料合成重要的化工产品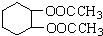 .合成路线流程图示例如下:
.合成路线流程图示例如下: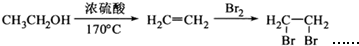 .
.