题目内容
15.下列递变规律正确的是( )| A. | 酸性 HF>HCl>HBr>HI | B. | 热稳定性 HI>HBr>HCl>HF | ||
| C. | 单质活动性 F2>Cl2>Br2>I2 | D. | 离子还原性 F->Cl->Br->I- |
分析 A.同主族元素的非金属性越强,对应氢化物的酸性越弱;
B、非金属性越强氢化物的稳定性越强,同主族自上而下元素的非金属性减弱;
C、同主族从上往下非金属性减弱,对应单质的氧化性减弱;
D、非金属性越强,对应离子的还原性越弱.
解答 解:A.非金属性F>Cl>Br>I,同主族元素的非金属性越强,对应氢化物的酸性越弱,则酸性强弱:HI>HBr>HCl>HF,故A错误;
B、同主族自上而下元素的非金属性减弱,故非金属性F>Cl>Br>I,所以氢化物稳定性HF>HCl>HBr>HI,故B错误;
C、同主族从上往下非金属性减弱,对应单质的氧化性减弱,所以单质活动性 F2>Cl2>Br2>I2,故C正确;
D、非金属性F>Cl>Br>I,对应离子的还原性为I->Br->Cl->F-,故D错误;
故选C.
点评 本题考查非金属元素的性质,明确同周期、同主族元素的性质变化规律及元素非金属性的比较方法是解答本题的关键,难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
6.下列现象或事实不能用同一原理解释的是( )
| A. | 加热碳酸氢铵晶体和氯化铵晶体都产生气体 | |
| B. | 漂白粉和双氧水都可用于漂白织物 | |
| C. | 臭氧和硫酸亚铁都可用于处理生活用水 | |
| D. | 向牛奶和豆浆中加入食醋都会出现絮凝物 |
6.在室温下等体积的酸和碱的溶液,混合后pH一定等于7的是( )
| A. | pH=3的硝酸和pH=11的氨水 | B. | pH=3的盐酸和pH=11的氨水 | ||
| C. | pH=3的硫酸和pH=11的KOH | D. | pH=3的醋酸和pH=11的KOH溶液 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L HF中含有原子数为2NA | |
| B. | 7.8 g Na2 0z中阴离子数目为0.2NA | |
| C. | 1 L 1 mol.L-1 KNO3溶液中O原子数为3NA | |
| D. | 常温常压下,44 g CO2和N2O的混合物中含有的质子数为22NA |
10.两种微粒的质子数相等,电子数也相等,它们不可能是( )
| A. | 一种单质分子和一种化合物分子 | B. | 一种阳离子和一种阴离子 | ||
| C. | 两种不同的阳离子 | D. | 两种不同的阴离子 |
20.在催化剂作用下,H2O2发生分解,其反应能量随反应的进程变化如图,下列说法正确的是( )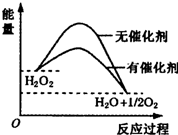

| A. | H2O2分解反应的△H>0 | |
| B. | 催化剂的加入使反应的热效应减小 | |
| C. | 催化剂的加入提高了H2O2的分解率 | |
| D. | 催化剂通过改变反应历程、降低反应的活化能来提高H2O2分解速率 |
4.常温时,下列块状金属中能全部溶于足量浓硝酸的是( )
| A. | Al | B. | Ag | C. | Fe | D. | Pt |
5.下列各组元素中按微粒半径递增顺序排列的是( )
| A. | Li Na K | B. | Ba2+ Ca2+ Mg2+ | C. | Ca2+ K+ Cl- | D. | N O F |