题目内容
11.关于下列四幅图中相应实验的说法错误的是( )
| A. | 图1中根据电流计(G)指针的偏转方向可比较Zn2+、Cu2+的氧化性强弱 | |
| B. | 图2中根据导气管中液面的变化可以判断铁钉发生了吸氧腐蚀 | |
| C. | 图3中若改用环形铜棒不会影响所测中和热的数值 | |
| D. | 图4中发生反应2NO2(g)?N2O4(g),根据两烧瓶中气体颜色深浅不同可判断其为放热反应 |
分析 A.根据电流计(G)指针的偏转方向可以判断电流方向,从而确定反应类型及离子氧化性强弱;
B.铁钉发生吸氧腐蚀时,导气管中液面上升;铁钉发生析氢腐蚀时,导气管中液面下降;
C.铜属于金属,易导热;
D.升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动.
解答 解:A.根据电流计(G)指针的偏转方向可以判断电流方向,从而确定哪种离子发生还原反应,从而确定两种离子氧化性强弱,故A正确;
B.铁钉发生吸氧腐蚀时,导气管中液面上升;铁钉发生析氢腐蚀时,导气管中液面下降,所以可以根据导气管中液面的变化可以判断铁钉发生了吸氧腐蚀,故B正确;
C.铜属于金属,易导热,所以不能改用环形铜棒不会影响所测中和热的数值,否则易导致测量值偏小,故C错误;
D.升高温度,平衡向吸热方向移动;降低温度,平衡向放热方向移动,且只有二氧化氮气体有颜色,所以根据两烧瓶中气体颜色深浅不同可判断其为放热反应,故D正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生分析判断能力,注意从实验评价性分析判断,易错选项是C.

练习册系列答案
相关题目
2.下列有关物质分类的正确组合是( )
| 分类 组合 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | Fe2O3 | CO2 |
| B | NaOH | NaHSO4 | NH4Cl | Na2O | NO2 |
| C | KOH | CH3COOH | NaClO | Na2O2 | SO2 |
| D | NH3•H2O | HNO3 | CaCO3 | CaO | SO3 |
| A. | A | B. | B | C. | C | D. | D |
6.下列现象或事实不能用同一原理解释的是( )
| A. | 加热碳酸氢铵晶体和氯化铵晶体都产生气体 | |
| B. | 漂白粉和双氧水都可用于漂白织物 | |
| C. | 臭氧和硫酸亚铁都可用于处理生活用水 | |
| D. | 向牛奶和豆浆中加入食醋都会出现絮凝物 |
16.下列对应关系不正确的是( )
| 选项 | A | B | C | D |
| 中心原子所在族 | ⅣA族 | ⅤA族 | ⅣA族 | ⅥA族 |
| 分子通式 | AB4 | AB3 | AB2 | AB2 |
| 立体构型 | 正四面体形 | 平面三角形 | 直线形 | V形 |
| A. | A | B. | B | C. | C | D. | D |
2.用1L0.5mol•L-1NaOH溶液吸收0.4molCO2,所以溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:1 |
19.下列说法中,正确的是( )
| A. | 液氯不导电是非电解质,氯水能导电是强电解质 | |
| B. | 在常温常压下,11.2升氯气所含的原子数目为NA | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 1mol氯气参加反应,转移的电子数一定为NA |
20.在催化剂作用下,H2O2发生分解,其反应能量随反应的进程变化如图,下列说法正确的是( )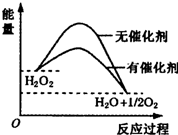

| A. | H2O2分解反应的△H>0 | |
| B. | 催化剂的加入使反应的热效应减小 | |
| C. | 催化剂的加入提高了H2O2的分解率 | |
| D. | 催化剂通过改变反应历程、降低反应的活化能来提高H2O2分解速率 |
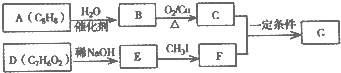
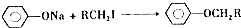

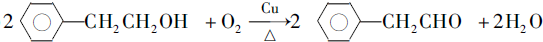 .
. .
.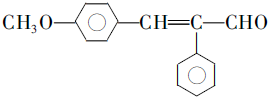 .
.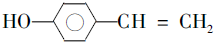 (写结构简式).
(写结构简式).