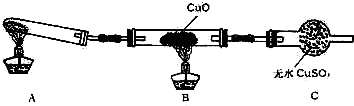
题目内容
 (1)写出实验室制取氨气的化学方程式:
(1)写出实验室制取氨气的化学方程式:(2)收集氨气使用
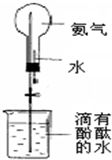
用如图装置进行喷泉实验(图中夹持装置均已略去).
(3)若用图中装置进行喷泉实验,上部烧瓶已装满干燥的氨气(标准状况),引发水上喷的操作是:
(4)实验完成后,求烧瓶内氨水的物质的量浓度为(不考虑NH3与H2O的反应)
考点:氨的制取和性质
专题:实验题
分析:(1)实验室用固体氯化铵和熟石灰粉末混合加热制取氨气,据此写出反应的化学方程式;
(2)氨气是易溶于水比空气轻的碱性气体,判断手机方法和干燥试剂选择,依据氨气遇到湿润的红色石蕊试纸变蓝检验氨气是否集满;
(3)利用氨气极易溶于水,形成压强差而形成喷泉;
(4)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,根据n=
计算氨气的物质的量,再根据c=
计算溶液的物质的量浓度.
(2)氨气是易溶于水比空气轻的碱性气体,判断手机方法和干燥试剂选择,依据氨气遇到湿润的红色石蕊试纸变蓝检验氨气是否集满;
(3)利用氨气极易溶于水,形成压强差而形成喷泉;
(4)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,根据n=
| V |
| Vm |
| n |
| V |
解答:
解:(1)实验室用氯化铵和消石灰反应生成氨气和氯化钙、水,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,不能用排水法收集,密度比空气小,用向下排空气法收集,氨气为碱性气体,用碱石灰干燥,检验氨气是否集满的方法是用湿润的红色石蕊试纸放在瓶口,观察颜色的变化,变蓝证明集满;
故答案为:向下排空气;碱石灰;用湿润的红色石蕊试纸放在瓶口,观察颜色的变化;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,故答案为:打开止水夹,挤出胶头滴管中的水;
(4)氨气溶于水,溶液体积等于氨气体积,设氨气的体积为22.4L,则溶液的体积为22.4L,标况下22.4L氨气的物质的量为:
=1mol,所得溶液的物质的量浓度为:
=0.045mol/L,
故答案为:0.045.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)氨气极易溶于水,不能用排水法收集,密度比空气小,用向下排空气法收集,氨气为碱性气体,用碱石灰干燥,检验氨气是否集满的方法是用湿润的红色石蕊试纸放在瓶口,观察颜色的变化,变蓝证明集满;
故答案为:向下排空气;碱石灰;用湿润的红色石蕊试纸放在瓶口,观察颜色的变化;
(3)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉,故答案为:打开止水夹,挤出胶头滴管中的水;
(4)氨气溶于水,溶液体积等于氨气体积,设氨气的体积为22.4L,则溶液的体积为22.4L,标况下22.4L氨气的物质的量为:
| 22.4L |
| 22.4L/mol |
| 1mol |
| 22.4L |
故答案为:0.045.
点评:本题考查了氨气的制备和性质、物质的量浓度的计算,题目难度不大,解答时需理解相关的原理,注意形成喷泉的原理和操作方法是解答的关键.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
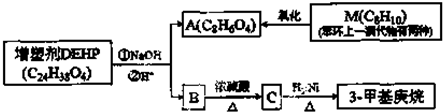
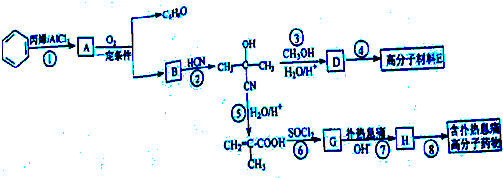
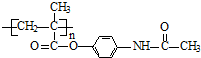 .
.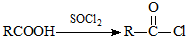

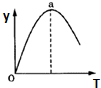 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)