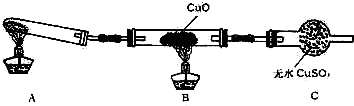
题目内容
粗食盐中常含有少量Ca2+、Mg2+、SO42-以及泥沙等杂质,实验室提纯NaCl的流程如下(加入的试剂稍过量)
称取粗盐
滤液
纯NaCl
(1)步骤③中加入的试剂A是 (填化学式),其目的是 . (2)第⑥步中,写出相应的离子方程式 .
(3)步骤⑤和⑥之间,若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 .
(4)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中过滤时,使用玻璃棒的目的是 .
(5)用上述方法获得的氯化钠去配制200mL0.1mol/LNaCl溶液.①用托盘天平称氯化钠固体的质量是 g
②配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和 . ③下列操作中,可能造成所配制溶液的浓度偏低的是 .
A、没有洗涤烧杯和玻璃棒
B、定容时,仰视刻度线读数
C、定容时,俯视刻度线读数
D、洗涤后的容量瓶中残留少量蒸馏水
(6)此方法获得的氯化钠溶液的导电性远远强于氯化钠固体,是因为氯化钠固体在水分子的作用下,电离成自由移动的离子,请写出相关的电离方程式: .
称取粗盐
| 溶解 |
| ① |
| BaCl2 |
| ② |
| 试剂A |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
(1)步骤③中加入的试剂A是
(3)步骤⑤和⑥之间,若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
(4)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中过滤时,使用玻璃棒的目的是
(5)用上述方法获得的氯化钠去配制200mL0.1mol/LNaCl溶液.①用托盘天平称氯化钠固体的质量是
②配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和
A、没有洗涤烧杯和玻璃棒
B、定容时,仰视刻度线读数
C、定容时,俯视刻度线读数
D、洗涤后的容量瓶中残留少量蒸馏水
(6)此方法获得的氯化钠溶液的导电性远远强于氯化钠固体,是因为氯化钠固体在水分子的作用下,电离成自由移动的离子,请写出相关的电离方程式:
考点:粗盐提纯
专题:
分析:根据镁离子会与氢氧根离子和碳酸根离子生成沉淀,钙离子会与碳酸根离子生成沉淀,硫酸根离子会与钡离子生成沉淀,加入盐酸可以除去过量的碳酸钠和氢氧化钠等进行分析,
(1)钡离子除去硫酸根离子、碳酸根离子除去钙离子和过量的钡离子,则镁离子选用用氢氧化钠溶液除去;
(2)过滤后的溶液中含有过量的碳酸钠、氢氧化钠,需要在第⑥步中加入盐酸除去杂质碳酸根离子、氢氧根离子,据此写出反应的离子方程式;
(3)CaCO3、BaCO3、Mg(OH)2沉淀可以溶解在盐酸中,生成一部分杂质,除杂效果不好;
(4)过滤时使用玻璃棒引流,避免液体流到漏斗以外;
(5)①根据n=cV计算出溶质的物质的量,再根据m=nM计算出需要氯化钠的质量,托盘天平的准确度为0.1g;
②根据配制一定物质的量浓度溶液的步骤选用仪器,然后判断还缺少的仪器;
③根据操作方法对物质的量浓度表达式c=
中n、V的影响进行判断;
(6)氯化钠为强电解质,在溶液中完全电离出钠离子和氯离子.
(1)钡离子除去硫酸根离子、碳酸根离子除去钙离子和过量的钡离子,则镁离子选用用氢氧化钠溶液除去;
(2)过滤后的溶液中含有过量的碳酸钠、氢氧化钠,需要在第⑥步中加入盐酸除去杂质碳酸根离子、氢氧根离子,据此写出反应的离子方程式;
(3)CaCO3、BaCO3、Mg(OH)2沉淀可以溶解在盐酸中,生成一部分杂质,除杂效果不好;
(4)过滤时使用玻璃棒引流,避免液体流到漏斗以外;
(5)①根据n=cV计算出溶质的物质的量,再根据m=nM计算出需要氯化钠的质量,托盘天平的准确度为0.1g;
②根据配制一定物质的量浓度溶液的步骤选用仪器,然后判断还缺少的仪器;
③根据操作方法对物质的量浓度表达式c=
| n |
| V |
(6)氯化钠为强电解质,在溶液中完全电离出钠离子和氯离子.
解答:
解:(1)钡离子可除掉硫酸根、碳酸钠溶液可以除去过量的钡离子和杂质钙离子,则加入试剂A的目的是除去镁离子,所以A为NaOH,
故答案为:NaOH;除去Mg2+;
(2)滤液中含有氢氧化钠、碳酸钠杂质,第⑥步中加入盐酸除去杂质碳酸根离子、氢氧根离子,反应的离子方程式有:H++OH-=H2O、2H++CO32-=CO2↑+H2O,
故答案为:H++OH-=H2O、2H++CO32-=CO2↑+H2O;
(3)由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调pH再过滤,导致少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,
故答案为:在酸性条件下,BaCO3、CaCO3、Mg(OH)2会溶解,从而使制得氯化钠的混有杂质;
(4)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中过滤时,使用玻璃棒的目的是引流,可以避免溶液流到漏斗外边,
故答案为:引流;
(5)①配制200mL 0.1mol/LNaCl溶液,需要氯化钠的物质的量为:0.1mol/L×0.2L=0.02mol,需要氯化钠的质量为:58.5g/mol×0.02mol=11.7g,用托盘天平需要称量1.2g氯化钠,
故答案为:1.2;
②配制200mL 0.1mol/LNaCl溶液,选用在200mL的容量瓶中配制,所以除了需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管,还需要200mL容量瓶,
故答案为:200mL容量瓶;
③A、没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A正确;
B、定容时,仰视刻度线读数,导致加入的蒸馏水体积超过容量瓶刻度线,配制的溶液体积偏大,浓度偏低,故B正确;
C、定容时,俯视刻度线读数,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,故C错误;
D、洗涤后的容量瓶中残留少量蒸馏水,对溶质的物质的量及最终溶液的体积都无影响,所以不影响配制结果,故D错误;
故答案为:AB;
(6)氯化钠在溶液中完全电离出钠离子和氯离子,电离方程式为:NaCl=Na++Cl-,所以氯化钠溶液的导电性远远强于氯化钠固体,
故答案为:NaCl=Na++Cl-.
故答案为:NaOH;除去Mg2+;
(2)滤液中含有氢氧化钠、碳酸钠杂质,第⑥步中加入盐酸除去杂质碳酸根离子、氢氧根离子,反应的离子方程式有:H++OH-=H2O、2H++CO32-=CO2↑+H2O,
故答案为:H++OH-=H2O、2H++CO32-=CO2↑+H2O;
(3)由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调pH再过滤,导致少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,
故答案为:在酸性条件下,BaCO3、CaCO3、Mg(OH)2会溶解,从而使制得氯化钠的混有杂质;
(4)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,其中过滤时,使用玻璃棒的目的是引流,可以避免溶液流到漏斗外边,
故答案为:引流;
(5)①配制200mL 0.1mol/LNaCl溶液,需要氯化钠的物质的量为:0.1mol/L×0.2L=0.02mol,需要氯化钠的质量为:58.5g/mol×0.02mol=11.7g,用托盘天平需要称量1.2g氯化钠,
故答案为:1.2;
②配制200mL 0.1mol/LNaCl溶液,选用在200mL的容量瓶中配制,所以除了需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管,还需要200mL容量瓶,
故答案为:200mL容量瓶;
③A、没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故A正确;
B、定容时,仰视刻度线读数,导致加入的蒸馏水体积超过容量瓶刻度线,配制的溶液体积偏大,浓度偏低,故B正确;
C、定容时,俯视刻度线读数,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液的浓度偏高,故C错误;
D、洗涤后的容量瓶中残留少量蒸馏水,对溶质的物质的量及最终溶液的体积都无影响,所以不影响配制结果,故D错误;
故答案为:AB;
(6)氯化钠在溶液中完全电离出钠离子和氯离子,电离方程式为:NaCl=Na++Cl-,所以氯化钠溶液的导电性远远强于氯化钠固体,
故答案为:NaCl=Na++Cl-.
点评:本题考查了粗盐的提纯、配制一定物质的量浓度的溶液,题目难度中等,试题知识点较多、综合性较强,注意掌握粗盐的提纯方法、配制一定物质的量浓度的溶液的方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
侯氏制碱法制备的工业产物主要是( )
| A、碳酸钠 | B、氢氧化钠 |
| C、碳酸氢钠 | D、氯化铵 |
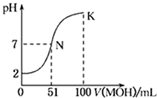 常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中正确的是( )| A、HA为一元强酸,MOH为一元强碱 |
| B、N点水的电离程度小于K点水的电离程度 |
| C、K点所示溶液中c(A-)>c(M+) |
| D、K点对应的溶液中,有c(MOH)+c(M+)=0.01mol/L |
 工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)
工业制氢气的一个重要反应是:CO(g)+H2O(g)?CO2(g)+H2(g)