题目内容
下列物质的转化在给定条件下能实现的是( )
①Fe
Fe2O3
Fe2(SO4)3
②SiO2
Na2SiO3
H2SiO3
③AlCl3
Al
NaAlO2
④Na
Na2O
NaOH
⑤SO2
H2SO3
H2SO4.
①Fe
| O2 |
| 点燃 |
| H2SO4 |
②SiO2
| NaOH |
| HCl |
③AlCl3
| 电解 |
| NaOH |
④Na
| O2 |
| 点燃 |
| H2O |
⑤SO2
| H2O |
| O2 |
| A、①⑤ | B、②③ | C、②⑤ | D、③④ |
考点:铁的化学性质,二氧化硫的化学性质,硅和二氧化硅,钠的化学性质,镁、铝的重要化合物
专题:元素及其化合物
分析:①Fe与氧气反应生成四氧化三铁;
②二氧化硅为酸性氧化物,与碱反应生成盐和水,硅酸盐与酸发生强酸制取弱酸的反应;
③氯化铝为共价化合物,不能电解生成Al;
④钠燃烧生成过氧化钠;
⑤二氧化硫与水生成亚硫酸,再被氧化生成硫酸.
②二氧化硅为酸性氧化物,与碱反应生成盐和水,硅酸盐与酸发生强酸制取弱酸的反应;
③氯化铝为共价化合物,不能电解生成Al;
④钠燃烧生成过氧化钠;
⑤二氧化硫与水生成亚硫酸,再被氧化生成硫酸.
解答:
解:①Fe与氧气反应生成四氧化三铁,则Fe
Fe2O3不能转化,故不选;
②二氧化硅为酸性氧化物,与碱反应生成盐和水,硅酸盐与酸发生强酸制取弱酸的反应,则SiO2
Na2SiO3
H2SiO3可转化,故选;
③氯化铝为共价化合物,不能电解生成Al,则AlCl3
Al不能转化,故不选;
④钠燃烧生成过氧化钠,则Na
Na2O不能转化,故不选;
⑤二氧化硫与水生成亚硫酸,再被氧化生成硫酸,则SO2
H2SO3
H2SO4可转化,故选;
故选C.
| O2 |
| 点燃 |
②二氧化硅为酸性氧化物,与碱反应生成盐和水,硅酸盐与酸发生强酸制取弱酸的反应,则SiO2
| NaOH |
| HCl |
③氯化铝为共价化合物,不能电解生成Al,则AlCl3
| 电解 |
④钠燃烧生成过氧化钠,则Na
| O2 |
| 点燃 |
⑤二氧化硫与水生成亚硫酸,再被氧化生成硫酸,则SO2
| H2O |
| O2 |
故选C.
点评:本题考查物质的性质,综合考查元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,注意不能电解氯化铝制备Al,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )| A、若甲为单质铁,则丙一定为FeCl3 |
| B、若甲为强碱,则X一定为CO2 |
| C、若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+ |
| D、若甲为单质,则此关系中涉及的反应一定都是氧化还原反应 |
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳.核黄素分子的结构为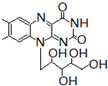 :
:
已知: +H2O
+H2O
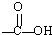 +
+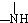 有关核黄素的下列说法中,不正确的是( )
有关核黄素的下列说法中,不正确的是( )
 :
:已知:
 +H2O
+H2O| H+ |
| △ |
 +
+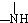 有关核黄素的下列说法中,不正确的是( )
有关核黄素的下列说法中,不正确的是( )| A、该化合物的分子式为C17H22N4O6 |
| B、酸性条件下加热水解,有CO2生成 |
| C、酸性条件下加热水解,所得溶液加碱后有NH3生成 |
| D、能发生酯化反应 |
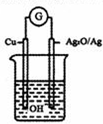 普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理,反应的总方程式为:2Cu+Ag2O═Cu2O+2Ag.下列有关说法正确的是( )| A、铜电极附近有黑色沉淀生成 |
| B、负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O |
| C、测量原理示意图中,电流方向从Cu经过导线流向Ag2O |
| D、电池工作时,溶液中OH-向正极移动 |
如图所示,将铁棒和石墨棒插入1Lmol?L食盐水中,下列说法错误的是( )


| A、若电键K与N连接,铁为负极 |
| B、若电键K与N连接,正极反应式是O2+2H2+4e-═4OH- |
| C、若电键K与M连接,将石墨棒成铜棒,可实现铁棒上镀铜 |
| D、若电键K与M连接,当两极共产生28L(标准状况)气体是,生成了1molNaOH |
下列依据相关数据作出的推理和判断中,不正确的是( )
| A、依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B、依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C、依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D、依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
卤素单质F2、Cl2、Br2、I2的密度的变化规律是( )
| A、逐渐增大 | B、逐渐减小 |
| C、不变 | D、没有规律 |
碱金属元素钠的电子层数是( )
| A、一层 | B、二层 | C、三层 | D、四层 |