题目内容
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( )| A、若甲为单质铁,则丙一定为FeCl3 |
| B、若甲为强碱,则X一定为CO2 |
| C、若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+ |
| D、若甲为单质,则此关系中涉及的反应一定都是氧化还原反应 |
考点:无机物的推断
专题:推断题
分析:A.若甲为单质铁,则X可以为氯气或溴、硝酸等;
B.若甲为强碱,则X可以为CO2、SO2、H2S等;
C.乙是一种白色胶状沉淀,若甲为铝盐、X为强碱、乙为氢氧化铝、丙为偏铝酸盐,若甲为偏铝酸盐、X为强酸、丙为铝盐;
D.若甲为单质,乙、丙中含有的甲元素化合价不同,均为氧化还原反应.
B.若甲为强碱,则X可以为CO2、SO2、H2S等;
C.乙是一种白色胶状沉淀,若甲为铝盐、X为强碱、乙为氢氧化铝、丙为偏铝酸盐,若甲为偏铝酸盐、X为强酸、丙为铝盐;
D.若甲为单质,乙、丙中含有的甲元素化合价不同,均为氧化还原反应.
解答:
解:A.若甲为单质铁,则X可以为氯气或溴、硝酸等,丙为FeCl3,FeCl3,Fe(NO3)3等,故A错误;
B.若甲为强碱,则X可以为CO2、SO2、H2S等,故B错误;
C.乙是一种白色胶状沉淀,若甲为铝盐、X为强碱、乙为氢氧化铝、丙为偏铝酸盐,若甲为偏铝酸盐、X为强酸、丙为铝盐,故C错误;
D.若甲为单质,乙、丙中含有的甲元素化合价不同,均为氧化还原反应,故D正确,
故选D.
B.若甲为强碱,则X可以为CO2、SO2、H2S等,故B错误;
C.乙是一种白色胶状沉淀,若甲为铝盐、X为强碱、乙为氢氧化铝、丙为偏铝酸盐,若甲为偏铝酸盐、X为强酸、丙为铝盐,故C错误;
D.若甲为单质,乙、丙中含有的甲元素化合价不同,均为氧化还原反应,故D正确,
故选D.
点评:本题考查无机物推断,难度中等,属于开放性题目,需要学生熟练掌握元素化合物知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
两种金属混合物19.6克,投入到一定量的盐酸中,反应完全后得到11.2L(标准状况)的氢气,此金属混合物不可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Mg和Cu |
| D、Fe和Zn |
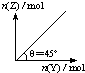 在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)?bZ(g)+W(g);△H>0平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示.下列说法中正确的是( )
在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g)?bZ(g)+W(g);△H>0平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示.下列说法中正确的是( )A、平衡时Y的转化率为
| ||
| B、向容器中再加入少量X,则Y的转化率增大 | ||
| C、再通入Y,重新达到平衡时W的体积分数不变 | ||
| D、保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
T℃时,体积相等的甲、乙、丙3个密闭的容器中,发生反应:CO2(g)+H2(g)?CO(g)+H2O(g),起始时充入各物质的物质的量如下表所示( )
则达到平衡时,CO的物质的量由大到小的顺序是.
| CO2 | H2(g) | CO(g) | H2O(g) | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | a mol | 2a mol | 0 | 0 |
| 丙 | a mol | a mol | 0 | a mol |
| A、n(甲)>n(乙)>n(丙) |
| B、n(甲)>n(丙)>n(乙) |
| C、n(乙)>n(丙)>n(甲) |
| D、n(乙)>n(甲)>n(丙) |
下列物质的性质、用途正确的是( )
| A、浓硫酸、浓硝酸都具有强氧化性,不能盛放在金属容器中 |
| B、Na2SiO3是制备硅胶和木材防火剂的原料 |
| C、食盐可作调味剂,不可作防腐剂 |
| D、合金的硬度大,熔点也高 |
下列说法正确的是( )
| A、将pH=5的硫酸溶液稀释500倍溶液中c(SO42-):c(H+)≈1:10 |
| B、常温下,将pH=5的醋酸溶液稀释100倍后溶液pH=7 |
| C、常温下,将pH=9的氢氧化钠溶液稀释100倍后溶液pH=7 |
| D、常温下,将0.01mol?L-1的硫酸溶液稀释100倍后溶液pH=4 |